 |
Auteur : Professeur Patrick Dallemagne On appelle isomères des composés chimiques possédant la même formule brute (ex : C4H10O), c’est à dire qui sont constitués du même nombre d’atomes. Deux types d’isomérie sont définis : l’isomérie plane et l’isomérie dans l’espace ou stéréoisomérie.

Isomérie plane
L’isomérie plane concerne des composés de même formule brute mais différant entre eux par leur formule semi-développée. On distingue trois sortes d’isomérie plane.
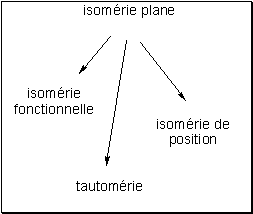
L’isomérie fonctionnelle
Il s’agit d’isomères ne possédant pas les mêmes fonctions chimiques. Ainsi, la formule brute C4H10O s’applique aussi bien à l’éther éthylique (formule semi-développée : CH3CH2OCH2CH3) qu’au n-butanol (formule semi-développée : CH3(CH2)3OH).

Ces produits chimiques diffèrent bien entendu grandement du point de vue de leurs propriétés physicochimiques.
L’isomérie de position
Il s’agit d’isomères possédant les mêmes fonctions chimiques, mais situées différemment dans la molécule. C ‘est le cas du n -butanol, du sec -butanol, de l’ iso -butanol et du ter -butanol, tous isomères de position entre eux :
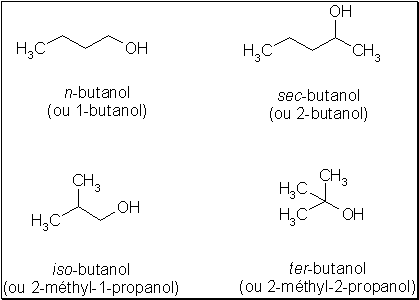
Ces alcools ne possèdent pas les mêmes caractéristiques physicochimiques. Ainsi par exemple, leur point d’ébullition est-il différent :
|
Point d’ébullition (sous pression ordinaire) |
|
|
n-butanol |
118°C |
|
sec-butanol |
100°C |
|
iso-butanol |
108°C |
|
ter-butanol |
83°C |
Chez les médicaments, l’isomérie de position pèse en général lourdement sur l’activité biologique. Par exemple la clozapine (Leponex®), une dibenzodiazépine chlorée en position 8, est un neuroleptique considéré comme atypique du fait de son affinité particulière pour les récepteurs sérotoninergiques 5HT2A et dopaminergiques D4 réduisant son caractère inducteur de syndrome extrapyramidal. L’isoclozapine, son isomère de position chlorée en position 2, se comporte en neuroleptique typique antagoniste des récepteurs D2.

La tautomérie
Il s’agit d’isomères possédant une fonction chimique qui peut adopter plusieurs formes en équilibre. La prépondérance de l’une par rapport à l’autre dépend des conditions de température et de pH. Il est cependant difficile de les séparer et leur présence n’est souvent objectivée qu’en spectrométrie d’absorption. La tautomérie s’observe par exemple entre les fonctions : • cétone et énol La n -butanone existe sous une forme cétone très majoritaire et sous une forme énol.

Le donépézil (Aricept®), un inhibiteur d’acétylcholinestérase de type indanone utilisé dans le traitement de la maladie d’Alzheimer, possède lui aussi une fonction cétone énolisable. La forme cétone est extrêmement prédominante.

• imine et énamine La fonction imine se prête elle aussi à la tautomérie, comme cela est illustré ci-dessous avec la cyclohexanimine.
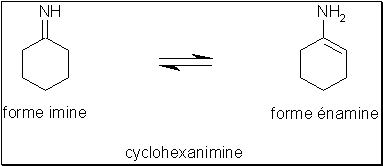
• lactame et lactime Les lactames (ou carboxamides intracycliques) s’équilibrent avec une forme lactime en général minoritaire. Cette tautomérie s’observe par exemple dans les bases puriques et pyrimidiniques constitutives des acides nucléiques telles que la thymine.

Elle s’observe aussi de ce fait avec les analogues nucléosidiques de ces bases, utilisés par exemple en virologie anti-HIV, comme c’est le cas pour la zidovudine ou AZT (Retrovir®).

La fonction guanidine peut se prêter à une inter conversion de même nature comme dans le cas de la clonidine (Catapressan®) qui est un antihypertenseur d’action centrale, agoniste des récepteurs adrénergiques a2 et des récepteurs aux imidazolines I-1. Ce principe actif possède un noyau imidazolidine porté par une fonction imine. Le motif guanidine ainsi formé peut s’équilibrer avec une forme tautomère de type amino-imidazoline.

