|
Auteur : Professeur Patrick Dallemagne
La stéréoisomérie concerne des composés possédant non seulement la même formule brute, mais aussi la même formule semi-développée. Ils diffèrent cependant entre eux par la disposition dans l’espace de leurs atomes.
On distingue principalement deux sortes de stéréoisomérie : celles dites de configuration et de conformation. La stéréoisomérie de torsion ou atropoisomérie, peu présente parmi les médicaments, ne sera pas abordée ici.

La stéréoisomérie de configuration
Les stéréoisomères configurationnels sont des composés chimiques bien distincts, isolables, dont l’inter-conversion nécessite la rupture de liaisons entre atomes. On distingue à nouveau deux sortes de stéréoisomérie configurationnelle : l’énantiomérie et la diastéréoisomérie.

L’énantiomérie
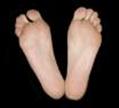
Des énantiomères sont des stéréoisomères de configuration, images non superposables l’une de l’autre dans un miroir, comme les deux mains (ou pieds…) d’un individu.
Ces composés possèdent des propriétés physico-chimiques identiques, à l’exception de leur pouvoir rotatoire. L’énantiomère qui dévie la lumière polarisée vers la droite est dit dextrogyre (+) celui qui la dévie vers la gauche est dit lévogyre (-). Le mélange, en proportions équivalentes, des deux énantiomères est qualifié de racémique (+/-). Il peut être séparé par des techniques particulières (chimiques, enzymatiques, chromatographiques…) pour fournir chacune des deux espèces à l’état isolé.
La plupart des cas d’énantiomérie concerne des composés présentant un carbone asymétrique (noté C*), c’est-à-dire porteur de quatre substituants différents.
La façon dont ceux-ci s’organisent dans l’espace permet d’attribuer par convention une configuration dite absolue à chacun des énantiomères. Ces configurations sont dites le plus souvent R ( rectus ) ou S ( sinister ). En chimie des sucres et des acides aminés, ces configurations sont quelques fois dites L ou D. Dans tous les cas, la nature de la configuration adoptée par convention, sur la base d’un classement par rang de priorité des substituants (règle de Cahn, Ingold et Prelog), est indépendante du pouvoir rotatoire mesuré expérimentalement (un énantiomère de configuration S peut être lévogyre ou dextrogyre et inversement).

La stéréochimie des médicaments revêt un rôle très important tant du point de vue de leur activité biologique que de leur comportement pharmacocinétique. En effet, l’action pharmacologique d’un médicament n’est souvent portée que par un seul des éantiomères autorisés par la présence d’un carbone asymétrique. Le second, dans le meilleur des cas se révèle inactif, mais il peut aussi être responsable d’une activité biologique opposée, voire d’effets secondaires délétères. L’utilisation d’un racémique peut donc conduire à doubler de façon inutile voire dangereuse la dose de médicament administrée.
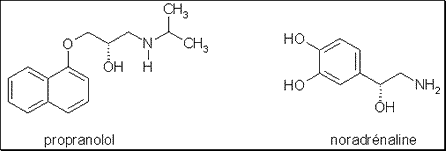
Malgré cela, la plupart des médicaments optiquement actifs sont utilisés sous la forme de leur racémique. C’est le cas par exemple des béta-bloquants (comme le propranolol, Avlocardyl®) utilisés la plupart du temps sous leur forme racémique notamment comme agents anti-hypertenseurs et dont les énantiomères lévogyres sont beaucoup plus actifs que les énantiomères dextrogyres. Ceci s’explique par le fait que les béta-bloquants doivent, pour exercer leur action antagoniste béta-adrénergique, présenter une analogie structurale étroite avec le ligand naturel de ces récepteurs : la noradrénaline de configuration lévogyre .
Certains médicaments sont cependant et depuis longtemps utilisés sous la forme du seul de leurs stéréoisomères actifs. C’est le cas par exemple de la lévo dopa (Sinemet®), l’énantiomère lévogyre de la dopa, un précurseur de la dopamine utilisé dans le traitement de la maladie de Parkinson. Celle-ci, en effet, doit se présenter sous la même forme énantiomérique que la dopa naturelle et ce d’autant plus qu’elle doit, pour être transformée en dopamine, subir l’action d’une enzyme spécifique de la forme lévogyre : la dopadécarboxylase.

Aujourd’hui certains laboratoires mettent sur le marché, après plusieurs années de commercialisation d’un principe actif racémique, la seule forme énantiomérique responsable de l’activité thérapeutique recherchée.
C’est le cas, par exemple, de l’esoméprazole (Inexium®), l’isomère lévogyre de configuration S de l’oméprazole dont le racémique est commercialisé depuis de nombreuses années (Mopral®) en tant qu’inhibiteur de la pompe à proton dans le traitement de l’ulcère gastro-duodénal. L’existence de deux énantiomères pour l’oméprazole est rendue possible par la présence dans sa structure d’un groupement sulfoxyde pyramidal, centre d’asymétrie comparable à un carbone C*.

L’énantiomère lévogyre de l’oméprazole serait moins rapidement dégradé que le dextrogyre ce qui lui confère en théorie une biodisponibilité soumise à moins de variations, moins d’interactions avec le système enzymatique du cytochrome P450 et une action plus rapide.
De la même façon, l’escitalopram (Seroplex®) est l’énantiomère de configuration S du citalopram dont le racémique (Seropram®) est utilisé en tant qu’antidépresseur inhibiteur sélectif de la recapture de la sérotonine. L ‘escitalopram se lierait au site de fixation allostérique du transporteur de la sérotonine plus efficacement que son énantiomère de configuration R .

Cette démarche de séparation des antipodes optiques d’intérêt thérapeutique est scientifiquement tout à fait louable, mais devrait plus souvent s’accompagner d’une réduction de la posologie administrée par rapport à celle du racémique pour ne pas être suspectée d’avoir été menée à de seules fins de prolongation de la propriété industrielle…
Il est enfin des cas où la présence des deux stéréoisomères est requise par le bénéfice thérapeutique attendu. Ainsi la mirtazapine (Norset®) a inauguré il y quelques années la nouvelle classe pharmacologique des antidépresseurs noradrénergiques et sérotoninergiques sélectifs.

Le carbone asymétrique de cette pipérazinopyridobenzazépine autorise l’existence de deux énantiomères. Ceux-ci participent différemment, mais tous les deux, au bénéfice thérapeutique recherché. L’isomère dextrogyre ( S ) antagonise les récepteurs pré synaptiques impliqués dans le rétrocontrôle négatif de la production de noradrénaline et de sérotonine, ce qui augmente la production de neurotransmetteurs. Dans le même temps ce même énantiomère antagonise les récepteurs post-synaptiques sérotoninergiques 5HT2, tandis que l’énantiomère dextrogyre antagonise pour sa part les récepteurs post-synaptiques sérotoninergiques 5HT3. Il en résulte que seuls les récepteurs post-synaptiques adrénergiques et sérotoninergiques 5HT1 sont activés par la production accrue de neurotransmetteurs (ce qui rendrait compte de l’activité anti-dépressive), tandis que l’absence d’action vis-à-vis des récepteurs 5HT2 et 5HT3 limiterait les effets secondaires délétères de la mirtazapine.
La diastéréoisomérie
Les diastéréoisomères sont des stéréoisomères configurationnels qui par ailleurs ne répondent pas à la définition de l’énantiomérie, c’est-à-dire qui ne sont pas images l’un de l’autre dans un miroir. Les diastéréoisomères, à la différence des énantiomères, ne possèdent pas les mêmes propriétés physico-chimiques. Ils peuvent de ce fait être plus facilement isolés par exemple au moyen d’une simple cristallisation fractionnée.
La diastéréoisomérie peut être secondaire soit à l’existence de plusieurs carbones asymétriques, soit à celle d’une double liaison.

Diastéréoisomérie due à la présence de plusieurs carbones asymétriques
La présence d’un carbone asymétrique autorise, on l’a vu, l’existence d’un racémique constitué de deux énantiomères ( S et R ). La présence d’un second carbone asymétrique entraîne l’existence de deux racémiques et de quatre stéréoisomères : RR , RS , SS et SR (si n est le nombre de C*, le nombre de racémiques est de 2 n-1 et le nombre d’énantiomères de 2 n ).
Ces racémiques sont constitués respectivement des couples de stéréoisomères RR et SS d’une part et RS et SR d’autre part. Ces couples sont énantiomères entre eux car images les uns des autres dans un miroir.
Les couples RR et RS , RR et SR , SS et RS , SS et SR constituent quant à eux des paires de diastéréoisomères car ils ne sont pas énantiomères entre eux.
En plus de la nomenclature R / S applicable à tous les cas de diastéréoisomérie, on peut utiliser aussi les termes érythro / thréo pour distinguer les couples d’énantiomères résultant de certains cas de diastéréoisomérie.
Cette terminologie relève d’ailleurs souvent d’un abus de langage car en toute rigueur, elle ne devrait concerner que les situations où les deux carbones asymétriques portent au moins deux substituants identiques.
Par ailleurs, dans le cas de composés alicycliques porteurs de plusieurs C*, on utilise en plus des termes R et S , ceux d’isomères cis et trans pour désigner les couples d’énantiomères dont les substituants, jugés prioritaires par convention, portés par les carbones asymétriques, se trouvent respectivement placés soit du même côté, soit de part et d’autre du plan moyen de la molécule considérée. Cette nomenclature relève, elle aussi, d’un abus de langage car elle devrait être réservée aux seuls composés cycliques dont aucun carbone n’est asymétrique.
Le méthylphénidate est un inhibiteur de recapture de la dopamine utilisé dans le traitement de la narcolepsie et des THADA (troubles de l’hyperactivité avec déficit de l’attention). Il s’agit d’un dérivé de type phénylpipéridineacétate de méthyle possédant deux carbones asymétriques. La spécialité Ritaline ® contient uniquement le mélange racémique des 2 formes thréo ( RR et SS ), les formes érythro ( RS et SR ) étant jugées peu actives et responsables d’une forte action hypertensive.
Cependant, parmi les deux formes thréo , seul l’énantiomère dextrogyre ( RR ) se révèle actif vis à vis du transporteur de la dopamine. Il est d’ailleurs commercialisé à l’état pur à l’étranger (FOCALIN Ò). L’isomère thréo lévogyre pour sa part antagonise partiellement l’action de son énantiomère. Il est d’ailleurs breveté en tant que son antidote.
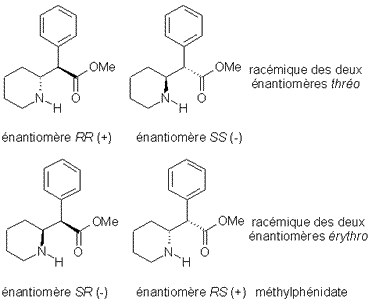
La consommation d’alcool (éthanol) lors de la prise de méthylphénidate provoque la trans -estérification de celui-ci en ester éthylique. Néanmoins celle-ci concerne majoritairement l’isomère lévogyre en épargnant le dextrogyre dont l’activité et la toxicité se trouvent augmentées par cette interaction qui le prive de son antagoniste. Ce phénomène est identique à celui observé entre l’alcool et la cocaïne.
La sertraline, un inhibiteur sélectif de la recapture de la sérotonine, constitue un exemple de principe actif de structure alicyclique pouvant adopter des configurations cis et trans . La spécialité anti-dépressive Zoloft® ne contient que l’énantiomère SS dextrogyre de la forme cis , seul porteur de l’action thérapeutique attendue.

Il faut enfin souligner que certains médicaments, notamment de structure pseudo peptidique, comportent un nombre élevé de carbones asymétriques, multipliant le nombre de diastéréoisomères possibles. C’est le cas par exemple des antiprotéases du HIV utilisés dans le traitement du SIDA. La configuration de chacun de ces carbones est imposée pour exercer l’action inhibitrice enzymatique recherchée.
Diastéréoisomérie due à la présence d’une double liaison
La présence dans un composé d’une double liaison C=C (éthylénique), C=N (oxime, imine, hydrazone…) ou N=N (pont diazonium) peut entraîner, dans le cas de substituants différents de part et d’autre de la double liaison, l’existence de deux diastéréoisomères. Celui, présentant du même côté de la double liaison les deux substituants jugés prioritaires par convention, est qualifié de forme Z ( Zusammen ). Celui, présentant ces deux substituants de part et d’autre de la double liaison, est qualifié de forme E ( Entgegen ).
Parmi les médicaments citons deux exemples de diastéréoisomérie E / Z . Le flupentixol est un neuroleptique de la famille des thioxanthènes. Seule la forme Z , présente dans la spécialité Fluanxol®, se révèle antagoniste des récepteurs dopaminergiques et exerce une action anti-psychotique.

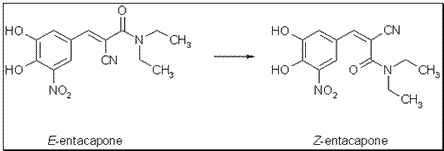
L’entacapone est un antiparkinsonien inhibiteur de dopadécarboxylase, utilisé en association à la lévo dopa pour éviter la transformation périphérique de celle-ci en dopamine. Le diastéréoisomère contenu dans la spécialité Comtan® est de configuration E (le groupement CO étant jugé prioritaire par rapport au groupement CN). Porteur de l’activité biologique, cet isomère subit au cours du métabolisme une isomérie partielle en configuration Z .
La stéréoisomérie de conformation
Les stéréoisomères conformationnels constituent les différentes représentations spatiales d’une même configuration. Il ne s’agit pas d’espèces chimiques isolables, le passage d’une conformation à l’autre s’effectuant par rotation autour de liaisons simples. Certains composés d’intérêt thérapeutique peuvent toutefois se révéler davantage actifs sous l’une ou l’autre de leurs conformations.
L’isomérie conformationnelle prend des formes différentes selon qu’elle concerne des composés aliphatiques, alicycliques et éventuellement en série biphényle.
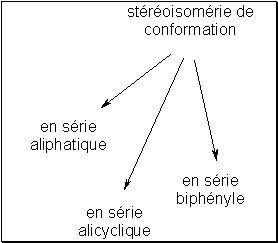
En série aliphatique , les conformations sont définies par les positions respectives que peuvent adopter les substituants portés par deux carbones adjacents. La nomenclature classique fait état de conformations éclipsée , décalée gauche ou décalée anti qui peuvent être davantage précisées à l’aide des termes syn , anti , périplanaire et clinal .
A titre d’exemple, la molécule de bromochloroéthane adopte ci-dessous sa conformation la plus stable décalée anti ou antipériplanaire.
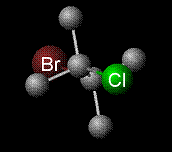
Conformation stable du bromochloroéthane
Si nous reprenons par ailleurs l’exemple du méthylphénidate, dont nous avons vu que seul l’énantiomère dextrogyre ( RR ) porte l’activité, il a été démontré qu’en outre c’est la conformation stabilisée par une liaison Hydrogène entre l’azote protoné au pH physiologique et le carbonyle de la fonction ester qui se trouve impliquée dans l’interaction avec le transporteur de dopamine.

Les composés de série alicyclique peuvent adopter diverses conformations dans l’espace en fonction de la taille du cycle. Ainsi un système cyclique à 6 côtés (cyclohexane, pipéridine, tétrahydropyrane…) peut se présenter sous des conformations en équilibre chaise , bateau ou croisée .

Certains composés de structure phényldihydropyridine possèdent des propriétés antagonistes calciques, c’est-à-dire qui inhibent les mouvements des ions Ca2+ au niveau des canaux calciques, exploitées notamment dans le traitement de l’hypertension artérielle. Les dérivés présentant des fonctions esters de nature différente de part et d’autre du noyau dihydropyridine (comme la félodipine, Flodil®) possèdent un carbone asymétrique autorisant l’existence de deux formes énantiomères. Bien que les spécialités commercialisées contiennent le mélange racémique des deux configurations, seule la forme R (-) porte l’activité.

Par ailleurs les dihydropyridines cumulent les deux sortes de stéréoisomérie de conformation. En effet elles adoptent tout d’abord généralement de façon privilégiée une forme bateau. Mais celle-ci, pour les dérivés substitués en ortho du noyau phényl par un atome d’halogène (comme la félodipine) se présente en outre en solution en mélange de deux conformations qualifiées de rotamères respectivement synpériplanaire et antipériplanaire .
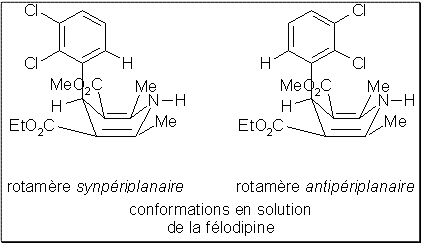
Il est généralement admis que c’est le rotamère synpériplanaire qui se lie au récepteur dihydropyridine des canaux calciques.
On peut enfin citer un cas particulier de stéréoisomérie de conformation qui concerne les dérivés de type biphényle . La libre rotation entre les deux noyaux aromatiques peut être entravée par la présence d’un groupement encombrant en position ortho de l’un des deux noyaux. Cette disposition spatiale entraîne l’existence d’un grand nombre de conformations qui se distinguent entre elles par l’angle entre les deux noyaux.
Le losartan (Cozaar®), un antagoniste des récepteurs AT1 à l’angiotensine-II utilisé comme agent antihypertenseur, de structure bipényle substituée par un noyau tétrazole, présente ce type de stéréoisomérie conformationnelle.
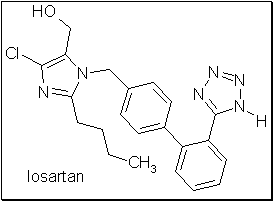
Il a été démontré que le conformère interagissant avec le récepteur cible présente un angle de 60° entre ses deux noyaux phényles.

Interactions du losartan au niveau du récepteur AT1
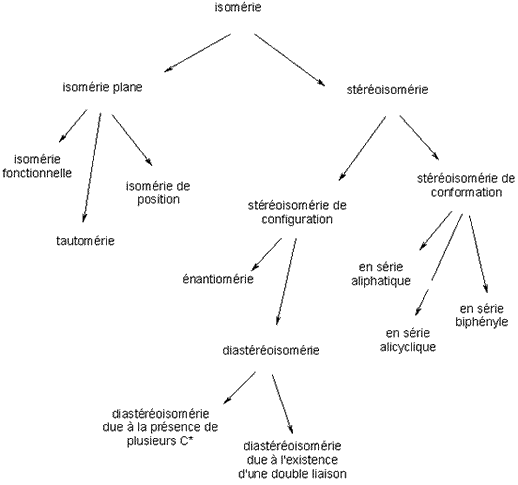
Le schéma ci-dessous résume les différentes sortes d’isomérie.
Bibliographie
M. Madesclaire “Stéréoisomérie, généralités et incidences en chimie thérapeutique.” Editions Ellipses, 1987 .
G. Rovnyak et al , J Med Chem , 1991 , 34, 2521-2524.
P. C. Melzer et al , J Med Chem , 2003 , 46, 1538-1545.
P. Zoumpoulakis et al , Chemistry and Physics of Lipids , 2003 , 125 13–25.
- Précédent
- Suivant