Rôle général
Le rôle biologique du fer est lié à son potentiel d’oxydoréduction dont la valeur dépend des ligands qui l’entourent.
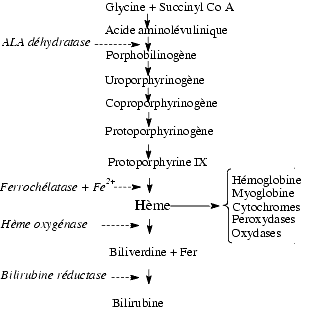
L’incorporation du fer dans la protoporphyrine, grâce à la ferrochélastase, la transforme en hème, constituant de base de l’hémoglobine, de la myoglobine, des cytochromes, de la catalase, des peroxydases, de la tryptophane pyrrolase.
- Incorporé à l’hème, le fer assure plusieurs fonctions :
- le transport d’oxygène du poumon aux tissus par l’hémoglobine présente dans les hématies, appelé fonction oxyphorique du sang. La déficience en fer se traduit par une anémie hypochrome.
- la fixation d’oxygène par la myoglobine musculaire qui a plus d’affinité pour l’oxygène que l’hémoglobine.
- l’oxydation de divers substrats, endogènes et exogènes comme de nombreux médicaments, par les cytochromes P-450 des microsomes.
- le catabolisme de l’eau oxygénée par la catalase.
- la respiration cellulaire, où les cytochromes des mitochondries assurent le transfert des électrons du substrat à l’oxygène.
- l’hème inhibe par rétrocontrôle l’activité de l’ALA déhydratase, enzyme régulatrice de sa synthèse.
- Lié à des protéines autres que l’hème, le fer intervient dans l’activité de nombreuses enzymes :
- l’aconitase où, lié à l’atome de soufre de la cystéine, il assure la transformation du citrate en isocitrate, étape métabolique du cycle de Krebs. Une hyperoxygénation inhibe l’aconitase.
- des monooxygénases qui assurent le transfert d’un atome d’oxygène sur un substrat. Parmi ces enzymes on peut citer : la phénylalanine hydroxylase, la tyrosine hydroxylase, la tryptophane-hydroxylase, ce qui explique qu’une déficience marquée en fer entraîne un défaut de synthèse des catécholamines dans le cerveau conduisant à une déficience intellectuelle, surtout chez l’enfant.
- la ribonucléotide réductase responsable de la transformation du ribonucléoside diphosphate en déoxyribonucléoside diphosphate, nécessaire à la synthèse du DNA.
- la lipooxygénase ainsi que la NADH ubiquinone réductase mitochondriale.
- Le fer « libre » catalyse la formation de radicaux libres selon la réaction de Fenton :
H2O2 + Fe2+¾® Fe3+ + OH– + OH
Il peut renforcer la phagocytose mais aussi certaines réactions radicalaires indésirables.
- Le fer régule son métabolisme en interagissant avec des protéines appelées IRP (iron regulatory proteins) lesquelles interagissent à leur tour avec des IRE (iron responsive elements) du mRNA. La traduction du mRNA en ferritine, transferrine, aconitase et en 5-aminolévulinate synthase est ainsi modulée en fonction de la concentration en fer.
Rôle dans les infections
Les relations entre le fer et l’infection sont complexes. Les germes, à l’exception des lactobacilles, ont besoin de fer pour leur croissance. Il y a compétition entre l’organisme et eux pour s’approprier le fer.
Dans l’organisme, la transferrine, la ferritine, la lactoferrine et, indirectement, l’hémopexine et l’haptoglobine, rendent le fer difficilement assimilable par les germes. De plus, l’organisme réagit aux infections en diminuant le fer accessible aux germes par d’autres mécanismes :
- diminution de l’absorption intestinale du fer
- rétention du fer de l’hémoglobine par les macrophages
- synthèse accrue de ferritine avec stockage du fer dans les tissus
- libération d’apolactoferrine par les neutrophiles au niveau des sites infectés
- synthèse d’anticorps vis-à-vis des protéines sécrétées par les microorganismes pour capter le fer.
Les germes possèdent diverses stratégies pour se procurer le fer à partir d’un milieu extrêmement pauvre en fer libre. On peut distinguer quatre possibilités :
- La réduction du fer ferrique Fe3+ grâce à des réductases présentes au niveau de la membrane bactérienne ou sécrétées dans le milieu. Le fer Fe2+ est ensuite capté par des microorganismes par des mécanismes faisant intervenir une ATPase membranaire.
- La fixation des complexes héminiques et de glycoprotéines comme la transferrine et la lactoferrine à des protéines de la membrane cytoplasmique qui sont synthétisées par les microorganismes lorsque le milieu est pauvre en fer.
- La synthèse et l’excrétion par les microorganismes de sidérophores qui sont des molécules de faible poids moléculaire, de 500 à 1000 daltons, ayant une grande affinité pour le fer. Le complexe fer-sidérophore est ensuite capté par le microorganisme grâce à des protéines de transport. Parmi les sidérophores, on peut citer l’entérobactine, l’aérobactine, la pyochéline, la pseudobactine, la déféroxamine. La synthèse des sidérophores est régulée par la concentration de fer à l’intérieur des microorganismes, grâce à des protéines spécifiques qui agissent sur des gènes appelés FUR (ferric uptake regulator).
- Certaines bactéries sécrètent des hémolysines qui, en lysant les érythrocytes, libèrent l’hémoglobine dont elles captent le fer. Le Plasmodium responsable du paludisme pénètre dans les érythrocytes très riches en fer pour y poursuivre son développement. Le fer est nécessaire au Plasmodium et la supplémentation en fer des populations dénutries en zone de paludisme endémique peut entraîner une recrudescence et une aggravation de la maladie. Inversement, la déféroxamine, chélateur du fer, administrée par voie parentérale, a un effet antipaludique.
- Certains germes, tels que Trichomonas vaginalis, ont besoin de fer pour assurer la synthèse d’adhésines qui leur permettent de se fixer aux cellules épithéliales.
- Une supplémentation en fer, au cours d’une infection aiguë à germes dont la prolifération est dépendante de la présence de fer, est susceptible d’aggraver l’infection.
- La prescription de fer au cours d’un état infectieux est à déconseiller. La carence en fer doit plutôt être corrigée en absence d’infection apparente
Rôle dans la croissance tumorale
Le fer est indispensable à la prolifération cellulaire et peut être considéré comme un facteur de croissance. Les cellules tumorales peuvent se procurer le fer nécessaire à leur développement, soit à partir de la transferrine grâce à des récepteurs membranaires, soit grâce à des peptides de faible poids moléculaire jouant le rôle de sidérophores. La déféroxamine inhibe in vitro la croissance de nombreuses tumeurs.
Des éléments comme le gallium qui est utilisé en cancérologie pourraient agir en entrant en compétition avec le fer, privant ainsi la cellule tumorale du fer nécessaire à sa croissance.