Les principaux chélateurs de type « dur » sont l’EDTA et la déféroxamine.
EDTA
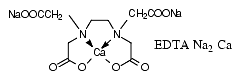
L’acide éthylènediamine tétra-acétique ou EDTA, appelé aussi acide édétique, existe sous forme de sel disodique, EDTA-Na2 et de sel disodique calcique EDTA-Na2Ca.
L’EDTA-Na2 est peu utilisé en thérapeutique, car il a une grande affinité pour le calcium et en cas d’administration intraveineuse rapide, il entraîne des hypocalcémies. Sa seule indication est le traitement des hypercalcémies graves et de l’intoxication digitalique, en absence d’autres moyens, notamment d’anticorps neutralisant la digoxine.
L’EDTA-Na2Ca peut être utilisé dans le traitement des intoxications par les métaux comme le plomb, le zinc, le manganèse, le fer, pour lesquels il a une plus grande affinité que pour le calcium. L’EDTA-ZnCa a été également utilisé en thérapeutique, en particulier dans le traitement de l’intoxication saturnine.
L’EDTA ne pénètre pas dans les cellules car, dans les milieux biologiques, il reste, même après chélation, des groupes R-COO– en excès, le rendant polaire et empêchant sa pénétration dans les cellules.
Sur le plan pharmacocinétique, l’EDTA-Na2Ca est peu absorbé par le tube digestif, moins de 5%. Il s’administre par voie parentérale, en perfusion intraveineuse le plus souvent, parfois en injection intramusculaire mais celle-ci peut être douloureuse. Sa demi-vie plasmatique est inférieure à une heure. Il se distribue dans le volume extracellulaire et son élimination urinaire est très importante, supérieure à 95%.
L’indication principale de l’EDTA-Na2Ca est le diagnostic et le traitement de l’intoxication saturnine. Il augmente l’élimination urinaire de plomb et peut-être aussi son passage dans le cerveau, sans que l’on sache s’il s’agit d’une forme toxique.
L’administration répétée d’EDTA-Na2Ca peut entraîner divers effets indésirables comme des frissons, des myalgies, mais surtout des lésions rénales, particulièrement au niveau du tubule proximal, peut-être par libération d’une fraction de l’élément toxique chelaté.
Par ailleurs, un traitement prolongé ou répété par l’EDTA peut entraîner une élimination excessive d’éléments essentiels comme le zinc, conduisant à une déficience.
L’EDTA dicobaltique, grâce au cobalt, fixe les ions cyanure CN– qui sont extrêmement toxiques du fait de leur affinité pour le fer. L’EDTA dicobaltique est souvent mal toléré et ne doit être utilisé qu’en cas d’intoxication cyanhydrique confirmée.
|
CALCIUM EDETATE* de sodium, Inj |
|
Le diéthylènetriamine pentaacétique ou DTPA a des propriétés proches de celle de l’EDTA. Il est utilisé sous forme de sel de zinc et serait le chélateur de choix pour le traitement des intoxications au plutonium. Il n’est pas commercialisé en France. Mais le plutonium se comporte comme le fer et peut être chélaté par la déféroxamine.
Un certains nombre de médicaments comme la chloroquine, la primaquine, certains neuroleptiques, possèdent une chaîne alkyl-diamine ressemblant à celle de l’EDTA et peuvent chélater certains métaux.
Trientine
La trientine ou triéthylènetétramine ou TRIEN comporte quatre atomes d’azote et possède des propriétés assez semblables à celles du DTPA et de l’EDTA. Elle a une affinité particulière pour le cuivre et est utilisée par voie orale dans le traitement de la maladie de Wilson. Elle entraine une déficience en fer qu’il faut compenser. Elle est commercialisée aux USA sous le nom de Syprine*.
Déféroxamine
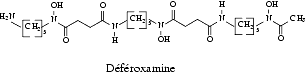
La déféroxamine, est un sidérophore, c’est-à-dire étymologiquement un porteur de fer, produit par Streptomyces pilosus surtout lorsqu’il pousse dans un milieu pauvre en fer.
La déféroxamine est un chélateur qui a une très grande affinité pour le fer ferrique Fe3+. Après fixation de Fe3+, elle se cyclise pour se transformer en féroxamine. Elle a aussi une grande affinité pour l’aluminium et, après fixation de l’aluminium, elle est transformée en aluminoxamine.
La déféroxamine est très soluble dans l’eau, s’administre par voie parentérale en perfusion car elle est très peu absorbée par le tube digestif.
La déféroxamine a trois indications principales :
- le traitement des surcharges en fer : la déféroxamine chélate le fer libre, une partie du fer fixé à l’hémosidérine, la ferritine et, à moindre degré, la transferrine, mais pas le fer fixé à l’hémoglobine et aux cytochromes. Elle est utilisée dans le traitement de la thalassémie majeure pour traiter la surcharge en fer qui résulte des transfusions sanguines fréquentes ainsi que dans le traitement de l’hémochromatose.
- le traitement des surcharges en aluminium, notamment celles que l’on a observées chez les dialysés chroniques.
- le traitement des troubles liés à des réactions radicalaires. Le fer favorise les réactions radicalaires et la déféroxamine a été utilisée pour prévenir ou réduire la gravité des lésions provoquées par les radicaux libres. La protection apportée par la déféroxamine est souvent évidente in vitro, mais beaucoup moins probante en clinique, peut-être en raison de son élimination rapide ne permettant pas de maintenir sa présence à une concentration efficace.
Les principaux effets indésirables de la déféroxamine sont, outre diverses manifestations allergiques, une diminution de l’acuité auditive comme celle que l’on observe avec certains antibiotiques et une diminution de l’acuité visuelle qui ne se voit qu’au cours des traitements prolongés et à doses élevées. Il y a possibilité d’aggravation par la déféroxamine de certaines infections, en particulier par Yersina enterocolitica.
Défériprone
La défériprone ou 1-diméthyl-3-hydroxypyridone, chélateur de synthèse ayant une grande affinité pour le fer et actif par voie buccale contrairement à la déféroxamine, est utilisée dans le traitement des surcharges en fer des malades atteints de ß-thalassémie et ne pouvant pas être traités par la déféroxamine
Le principal effet indésirable de la défériprone qui nécessite une surveillance hématologique préventive est l’agranulocytose.
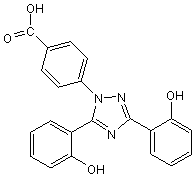
Déférasirox
En présence de fer ferrique, Fe 3+, 2 molécules de déférasirox forment avec un atome de fer ferrique un chélate stable hexadenté. Comme les autres chélateurs du fer, le déférasirox chélate aussi l’aluminium avec une grande affinité mais moindre que celle qu’il a pour le fer. Il a beaucoup moins d’affinité pour le zinc et pour le cuivre.
Le déférasirox augmente l’élimination du fer dans les selles (élimination biliaire) et diminue la concentration de fer dans les tissus, notamment dans le foie, mais serait moins efficace au niveau du coeur. Il est indiqué dans le traitement des surcharges chroniques en fer.
Le déférasirox pris par voie buccale, l’estomac vide, 30 minutes avant le repas, est absorbé par le tube digestif, sa biodisponibilité étant d’environ 70 %. Dans le plasma il se fixe largement aux protéines plasmatiques. Il pénètre dans les cellules et est éliminé essentiellement par voie biliaire.
|
Déférasirox |
EXJADE* Cp à 125 et 500 mg |
Dexrazoxane
Le dexrazoxane est une prodrogue qui se transforme après pénétration dans la cellule en métabolites chélateurs du fer. Lorsque le dexrazoxane est administré en même temps qu’une anthracycline comme la doxorubicine et la daunorubicine, le complexe anthracycline/fer formé dans la cellule hydrolyse le dexrazoxane en métabolites dont la structure est proche de celle de l’ETDA. Ces métabolites, en particulier l’un d’entre eux, chélatent le fer intracellulaire et forment un complexe avec l’anthracycline/fer, réduisant ainsi la production de radicaux libres. Le dexrazoxane est utilisé dans la prévention de la cardiotoxicité induite par les anthracyclines.
Autres chélateurs
Il existe d’autres chélateurs particulièrement avides de fer :
- la desferrithiocine, également d’origine bactérienne
- un dérivé synthétique ressemblant à l’entérobactine et appelé trencam qui a une constante d’affinité de 1043 pour le fer
- l’entérochéline qui peut chélater le fer mais aussi le scandium, l’indium et avoir des propriétés bactériostatiques, probablement en privant les germes pathogènes de leur apport en fer
- le tiron (catéchol-disulfonate) qui est un chélateur du fer et de l’uranium. Ce serait le chélateur le plus efficace dans le traitement de l’intoxication par l’uranium.
Les chélateurs du fer peuvent trouver des indications nouvelles en dehors de toute surcharge en fer dans le traitement antioxydant, comme anti-infectieux vis-à-vis de certains germes, dont le plasmodium, et comme antitumoraux.
Ligands toxiques
Lorsqu’un complexant a la capacité d’inactiver un élément indispensable au fonctionnement cellulaire comme le fer, il est extrêmement toxique. C’est le cas du cyanure, du monoxyde de carbone et de l’hydrogène sulfuré. Ce sont trois molécules de faible encombrement capables d’atteindre le fer lié aux protéines comme celui du cytochrome c.
Cyanure
Le cyanure, CN–, et en particulier l’acide cyanhydrique CNH autrefois appelé acide prussique, est un des chélateurs les plus toxiques car il diffuse facilement.
La toxicité immédiate de CN– provient de sa très grande affinité pour le fer ferrique Fe3+. En se fixant au fer de la cytochrome oxydase mitochondriale, il bloque la respiration cellulaire et entraîne la mort.
L’acide cyanhydrique est utilisé dans certaines applications industrielles, notamment en synthèse organique, et comme raticide dans la désinfection des bateaux. Il peut également provenir de la combustion de certains plastiques contenant de l’azote au cours des incendies.
Dans l’organisme, il se forme une faible quantité de cyanure provenant du métabolisme des nitrites et des thiocyanates organiques sous l’influence de la glutathion transférase et de certains médicaments comme le nitroprussiate (Nipride* utilisé comme vasodilatateur).
Le traitement de l’intoxication cyanhydrique doit être extrêmement rapide pour avoir quelque chance de succès. Le but du traitement est de détacher le cyanure ou mieux d’empêcher sa fixation au fer de la cytochrome oxydase. Pour cela, il existe plusieurs possibilités :
- Administrer un métal qui a beaucoup d’affinité pour le cyanure :
- Accélérer l’inactivation du cyanure :
Na2S2O3 + CN– ¾® SCN– + Na2SO3
- Transformer l’hémoglobine en méthémoglobine :
- Le fer de l’hémoglobine a peu d’affinité pour l’anion CN– alors que le fer de la méthémoglobine réagit avec lui pour donner de la cyanméthémoglobine. En transformant une partie seulement de l’hémoglobine en méthémoglobine, on tend à déplacer le cyanure de la cytochrome oxydase vers la méthémoglobine. Pour oxyder l’hémoglobine en méthémoglobine, on utilise des agents comme le nitrite de sodium, NaNO2, par voie intraveineuse ou encore le 4-diméthyl-aminophénol.
- Enfin, l’oxygène hyperbare favorise l’effet des antidotes précédents.
Monoxyde de carbone et hydrogène sulfuré
- Le monoxyde de carbone, CO, est un gaz produit par certains appareils de chauffage. Il est à l’origine d’intoxications graves et, comme le cyanure, il inhibe la respiration mitochondriale. Mais sa toxicité provient surtout de sa fixation à l’hémoglobine qui, dès lors, ne peut plus remplir son rôle de transporteur d’oxygène.
- L’hydrogène sulfuré, SH2, est un gaz qui en milieu aqueux donne l’équilibre suivant :

Bonjour
Dans le cadre d’un roman que je suis en train d’écrire, serait-il possible d’avoir quelques précisions sur le cyanure.
1) Dans mon scénario, les victimes meurent d’une injection de cyanure après 2 mn.( Convulsions,coma, arrêt cardiaque )
Les médecins secouristes se rendent ils compte que c’est un meurtre ? Ou pensent ils que ça pourrait être du à une crise cardiaque?
2) Si une personne pense qu’elle risque d’être là prochaine victime, peut elle anticiper en prenant un antidote ? Et peut-elle s’en sortir ?
Merci d’avance, pour ces précisions qui feront avancer sans aucun doute mon roman.
Simplement quelques remarques:
Le cyanure est toxique, mortel, par ingestion (voie buccale) sans nécessiter une injection. Le fait de l’injecter complique un peu la réalisation.
Le recours à un antidote pour prévenir les effets du cyanure est peu vraisemblable. On pourrait cependant imaginer qu’une injection, dans ce cas une injection serait nécessaire, d’une très forte dose d’hydroxocobalamine peu de temps avant la prise de cyanure pourrait neutraliser ce dernier.