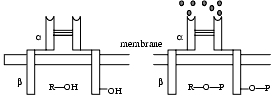Un récepteur peut être défini comme une structure moléculaire de nature polypeptidique qui interagit spécifiquement avec un messager, hormone, médiateur, cytokine, ou à un contact intercellulaire spécifique. Cette interaction crée une modification du récepteur qui conduit, par exemple, à l’ouverture du canal lié au récepteur, ou se transmet par l’intermédiaire de réactions enzymatiques à l’effecteur distant du récepteur.
Les récepteurs sont situés soit au niveau de la membrane cytoplasmique, soit à l’intérieur de la cellule, dans le noyau notamment. La même cellule comporte en général plusieurs types de récepteurs différents.
Récepteurs membranaires
Un récepteur membranaire comporte une partie extracellulaire où se trouve le site de reconnaissance de la molécule informative, une partie transmembranaire et une partie intracellulaire.
Pour activer un récepteur membranaire, la molécule informative n’a pas à pénétrer dans la cellule. L’activation des récepteurs membranaires par les messagers déclenche des modifications qui peuvent rester localisées à la membrane, s’étendre à l’ensemble du cytoplasme ou atteindre le noyau. Dans ce dernier cas l’activation met en jeu une cascade de réactions enzymatiques intracellulaires, se poursuivant jusqu’au noyau, pour modifier la transcription du DNA en RNA. L’ensemble des réactions qui se déroulent entre l’activation du récepteur membranaire et l’effet cytoplasmique ou nucléaire est généralement appelé transduction du signal, le terme transduction seul pouvant avoir d’autres significations.
Les chemins suivis par le signal sont appelés voies de signalisation; ces voies sont nombreuses et diverses, interconnectées et interdépendantes, pouvant se suppléer. On peut les comparer à une carte routière qui peut être très sommaire ou infiniment détaillée. Nous en donnons ici une vue générale simplifiée destinée à faciliter la compréhension du mode d’action des médicaments
La densité, c’est-à-dire le nombre de récepteurs au niveau des cellules, est régulée. Elle tend à diminuer lorsque la concentration du médiateur augmente, et on parle de « down-regulation » avec possibilité d’intériorisation de certains récepteurs. Elle tend à augmenter lorsque la concentration du médiateur s’abaisse, et on parle de « up-regulation ». Ce mécanisme qui comporte généralement des phosphorylations ou des déphosphorylations de la partie intracellulaire du récepteur, explique au moins partiellement les phénomènes d’hyposensibilité ou d’hypersensibilité au médiateur. Cette régulation qui a été étudiée sur des récepteurs membranaires, permet de moduler quantitativement la réponse d’une cellule à un médiateur.
De plus certains récepteurs sont inductibles, c’est-à-dire qu’ils ne sont pas présents spontanément dans une cellule mais peuvent apparaître après avoir été induits par un stimulus, par exemple une cytokine. Cette induction qui concerne des récepteurs membranaires ou intra-cellulaires, peut modifier qualitativement la réponse de la cellule.
On peut distinguer schématiquement trois types de récepteurs membranaires : les récepteurs canaux, les récepteurs enzymes et les récepteurs liés aux protéines G.
Récepteurs-canaux
Ces récepteurs comportent un canal qui fait communiquer le cytoplasme avec le milieu extracellulaire. La molécule informative module l’ouverture du canal et régule, en général, l’entrée dans la cellule soit des cations Na+ ou Ca2+, soit d’anions Cl–.
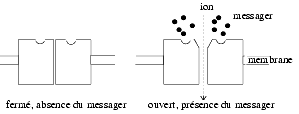
Ces récepteurs-canaux sont à différencier, d’une part des canaux voltage-dépendants dont l’ouverture est régulée par le potentiel membranaire, une dépolarisation cellulaire favorisant leur ouverture, et d’autre part des canaux dont l’ouverture est régulée par l’intermédiaire d’une variation de la concentration intracellulaire du Ca2+, de l’AMPc ou du GMPc.
La caractéristique générale des récepteurs canaux est d’avoir une réponse instantanée et de courte durée. L’ouverture du canal nécessite souvent l’interaction simultanée de deux molécules activatrices : c’est le cas du récepteur nicotinique à l’acétylcholine et du récepteur GABAA.
- Les récepteurs-canaux cationiques :
- Les récepteurs-canaux anioniques comme le canal chlorure Cl–:
Récepteurs-enzymes
Le récepteur possède lui-même une activité enzymatique. Son activation par le messager module cette activité qui est de type kinase ou phosphatase ou guanylate cyclase :
- de type protéine kinase. La plupart d’entre eux sont des récepteurs tyrosine kinases, désignés habituellement par RTK, un des plus connus étant le récepteur à l’insuline, mais il en existe aussi à activité sérine/thréonine kinase.
Le récepteur de l’insuline est formé de deux sous-unités a et de deux sous-unités ß. Lors de la stimulation par l’insuline, il y a autophosphorylation de la partie intracellulaire du récepteur (un groupe –OH porté par un résidu tyrosyl devient –O–P) et phosphorylation de l’IRS (insulin receptor substrate) attenant au récepteur (R–OH ® R–O–P). Ces protéines dont la phosphorylation s’effectue sur un groupe OH enclenchent des réactions enzymatiques qui seront à l’origine des effets biologiques observés.
Récepteur tyrosine kinase- Les récepteurs protéines kinases, comme celui de l’hormone de croissance, mettent en jeu un ensemble de voies de signalisation complexes. La stimulation du récepteur par l’hormone, provoque la dimérisation du récepteur, sa phosphorylation et l’activation de la phospholipase C (PLC), des voies STAT (signal transducer and activator of transcription), MAPK (mitogen activated protein kinase) qui interviennent dans la transcription de plusieurs gènes et la voie IRS (insulin receptor substrate).
- Il existe également des récepteurs-enzymes à activité tyrosine phosphatase, entraînant au contraire une déphosphorylation de résidus tyrosyl.
- de type guanylate cyclase
- L’activation de ce récepteur-enzyme provoque la formation, à partir de la guanosine triphosphate (GTP), de guanosine monophosphate cyclique (GMPc) qui active des protéines kinases.
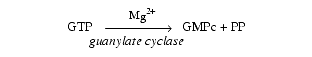
- On peut distinguer deux sortes de guanylate cyclase, l’une membranaire qui est activée par des messagers comme le facteur natriurétique atrial ou ANF, l’autre soluble, présente dans le cytoplasme et qui est activée par le monoxyde d’azote qui diffuse à travers les membranes.
- Le GMPc a de nombreux effets encore mal précisés et différents selon les cellules : il agit directement en activant les phosphodiestérases et certains canaux de la membrane plasmique et surtout indirectement par l’intermédiaire de la protéine kinase PKG qui par phosphorylation de plusieurs protéines entraîne divers effets : inactivation de la phospholipase C, ouverture de canaux potassiques, activation de l’ADP-ribosylcyclase qui catalyse la transformation du NAD+ en ADP-ribose-cyclique appelé cADPR, susceptible d’activer le récepteur à la ryanodine du réticulum endoplasmique.
- L’activation de ce récepteur-enzyme provoque la formation, à partir de la guanosine triphosphate (GTP), de guanosine monophosphate cyclique (GMPc) qui active des protéines kinases.
Récepteurs liés aux protéines G
Les récepteurs liés aux protéines G sont ainsi appelés parce que leur activité nécessite la présence de guanosine diphosphate (GDP) qui est phosphorylée pour donner la guanosine triphosphate (GTP). Cette phosphorylation pourrait être couplée à un transfert préalable de protons comme source d’énergie.
Les récepteurs liés aux protéines G sont de nature polypeptidique et comportent une partie extracellulaire portant le site de liaison avec le messager, une partie transmembranaire à sept hélices (parce que la chaîne polypeptidique traverse la membrane sept fois) et une partie intracellulaire en contact avec les protéines G qui assurent le transfert et l’amplification du signal reçu par le récepteur.
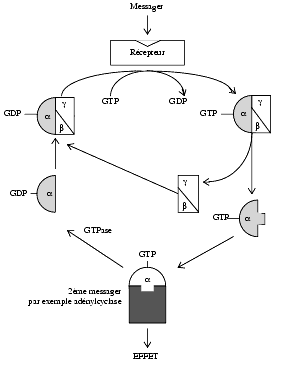
Chaque protéine G est hétérotrimérique, c’est-à-dire constituée de trois sous-unités différentes a, ß et g, ces deux dernières formant un complexe hétérodimérique. La stimulation du récepteur conduit à leur dissociation. Le rôle de la sous-unité a est le mieux connu.
- la sous-unité a, à l’état non actif, comporte une guanosine diphosphate (a-GDP) et est liée aux sous-unités ß et g.
- lors de l’activation du récepteur, il y a phosphorylation du GDP fixé à la sous-unité a-GDP qui devient a-GTP, et, ainsi phosphorylée, se sépare des sous-unités ß et g.
- la sous-unité a-GTP module l’activité d’enzymes différentes selon les cellules et entraîne les effets correspondants.
- l’hétérodimère ßg module également certaines activités enzymatiques.
- une GTPase déphosphoryle la sous-unité a qui de a-GTP devient a-GDP, laquelle s’associe aux sous-unités ßg pour donner un ensemble inactif.
Les substances susceptibles d’interagir avec les récepteurs couplés aux protéines G sont extrêmement nombreuses et diverses: petites molécules comme les catécholamines, peptides et polypeptides, molécules odorantes ainsi que l’ion calcium et la lumière.
L’effet obtenu dépend essentiellement des GTP-a comme indiqué dans le schéma ci-dessus
Le complexe ßg à qui on ne connaissait pas initialement d’activités en possède en réalité comme l’activation de phospholipases et de MAP-kinases et la modulation de canaux sodiques ou calciques (activités non indiquées dans le schéma simplifié ci-dessus).
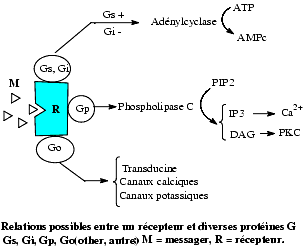
L’effet observé dépend donc essentiellement de la nature de a; il y a différents types de sous-unités a, notamment les as et ai, qui sont présentes dans la quasi-totalité des cellules
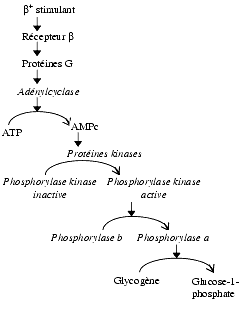
- L’as de la protéine Gs (s pour stimulant) provoque une activation de l’adénylcyclase avec augmentation de la synthèse d’AMP cyclique
- La toxine du choléra, en catalysant la ribosylation de la sous-unité a par transfert de l’adénosine-diphosphate-ribose à partir du nicotinamide-adénosine-dinucléotide ou NAD, maintient à l’état activé la protéine Gs qui stimule l’adénylcyclase responsable de l’augmentation de la synthèse d’AMPcyclique et de sécrétion de chlorure et d’eau par la muqueuse intestinale.
- La forskoline, un diterpène, stimule directement l’adénylcyclase sans intervention des protéines G.
- L’ai de la protéine Gi (i pour inhibiteur) inhibe l’adénylcyclase et diminue la synthèse d’AMPcyclique.
- La toxine de la coqueluche (Bordetella pertussis) inhibe la protéine Gi, ce qui tend à augmenter la production d’AMPcyclique. Par un mécanisme différent de celui de la toxine du choléra, elle aboutit à un résultat semblable.
- L’hypothyroïdie pourrait augmenter la concentration relative de ai par rapport à as.
- L’at de la protéine Gt (t pour transducine) est présente au niveau des cellules photo-réceptrices et active une phosphodiestérase qui détruit le GMPc dont le rôle était de maintenir ouverts les canaux sodiques à l’origine de la dépolarisation du nerf optique. La diminution du GMPc entraîne une hyperpolarisation.
- L’ao (o pour other = autre) des protéines Go, parmi lesquelles on peut distinguer des protéines Gp, Gk, GCa.
L’activité des protéines G est de courte durée car une GTPase, partie intégrante des protéines G, hydrolyse l’a-GTP actif en a-GDP inactif qui se lie aux sous-unités ßg.
Par ailleurs les récepteurs liés aux protéines G peuvent interagir avec des protéines appelées arrestines qui se fixent aux récepteurs et les désensibilisent.
En résumé, les protéines G assurent le transfert de l’information du récepteur à des enzymes dont elles régulent l’activité. Ces enzymes sont, selon les cellules, l’adénylcyclase, la phospholipase C, la guanylate cyclase et nous allons brièvement en rappeler le rôle.
Rôle de l’adénylcyclase
L’adénylcyclase assure, en présence de Mg2+, la transformation de l’ATP en AMP cyclique libérée dans le cytoplasme. C’est une enzyme à localisation trans-membranaire dont le site actif est intracytoplasmique.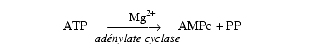
La protéine Gs augmente l’activité de l’adénylcyclase et la production d’AMP cyclique, la protéine Gi a l’effet inverse.
L’AMP cyclique est un activateur enzymatique, notamment des protéines kinases A (PKA) dont le rôle est de phosphoryler un certain nombre de protéines. La protéine kinase A est un tétramère composé de deux unités catalytiques et de deux unités régulatrices. La fixation d’AMP cyclique sur les unités régulatrices libère sous forme active les unités catalytiques qui phosphorylent des acides aminés thréonine et sérine, constituants de protéines qui sont souvent elles-mêmes des enzymes.
La durée de vie de l’AMP cyclique dans le cytoplasme est courte car il est inactivé par les phosphodiestérases en 5-AMP inactif. L’inhibition des phosphodiestérases prolonge la durée de vie et l’activité de l’AMPc. Les deux plus anciens inhibiteurs des phosphodiestérases sont la théophylline et la caféine qui ont, en outre, d’autres mécanismes d’action, en particulier un effet antagoniste vis-à-vis de l’adénosine.
Les inhibiteurs de phosphodiestérases particulières, dites de type III, présentes au niveau du myocarde, renforcent les contractions cardiaques. Ces inhibiteurs sont l’amrinone, la milrinone et l’énoximone.
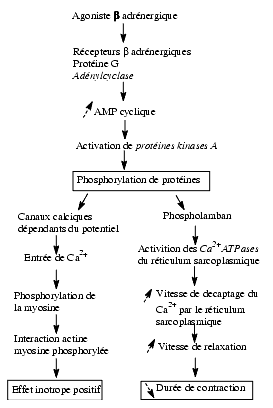
Trois exemples illustrent la cascade de réactions impliquant une augmentation de la concentration de l’AMPc à la suite de la stimulation de récepteurs ß-adrénergiques et ses conséquences : la transformation du glycogène en glucose-1-phosphate, la stimulation cardiaque et la relaxation d’un muscle lisse.
- Transformation du glycogène musculaire en glucose-1-phosphate sous l’influence de la phosphorylase a, activée indirectement par l’AMPc.
Formation de glucose-1-phosphate à partir du glycogène sous l’effet d’un agoniste adrénergique b
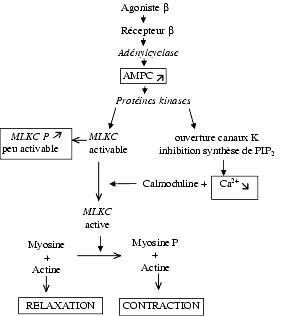
- Relaxation d’un muscle lisse : la relaxation des bronches sous l’effet de l’augmentation de la concentration intracellulaire d’AMPc peut s’expliquer par deux mécanismes complémentaires, d’une part la phosphorylation de la MLCK (myosin light chain kinase) qui, ainsi phosphorylée, devient moins activable par le complexe calcium-calmoduline et donc moins active, d’autre part par la diminution du calcium intracytoplasmique, ce qui réduit l’activation de la calmoduline.
Mécanisme de la relaxation d’un muscle lisse sous l’effet d’un agoniste adrénergique b
- Stimulation cardiaque : l’augmentation de la force des contractions des fibres myocardiques résulte de la phosphorylation des canaux calciques. La phosphorylation des canaux calciques favorise l’entrée de calcium; l’augmentation de la vitesse de relaxation résulte essentiellement de la phosphorylation du phospholamban. Le phospholamban non phosphorylé inhibe la pompe Ca2+-ATPase du réticulum sarcoplasmique. Sa phosphorylation lève cette inhibition et la vitesse de captation du calcium par le réticulum sarcoplasmique augmente, ce qui raccourcit la durée de la contraction.
Rôle de la phospholipase C
La protéine Gp active la phospholipase C, encore appelée phospho-inositidase, qui, entre autres fonctions, transforme le phosphatidylinositol 4,5-biphosphate (PIP2) membranaire en diacylglycérol (DAG) qui reste au contact de la membrane lipidique et en inositol 1,4,5 triphosphate (IP3) qui diffuse dans le cytoplasme. Des phospho-inositol kinases dont la PI 4-kinase régénère le PIP2 à partir de l’IP3.
Le DAG est un activateur de la protéine kinase C (PKC) membranaire qui comporte plusieurs molécules de cystéine et des atomes de zinc. La PKC catalyse, en présence obligatoire de Ca2+ et peut-être de phosphatidylsérine, la phosphorylation d’un certain nombre de substrats intervenant dans la transmission synaptique, la différenciation cellulaire, l’exocytose, etc. La phosphorylation s’effectue à partir de l’ATP sur les groupes OH des acides aminés sérine et thréonine mais non tyrosine. Le phorbol, un triterpène qui active la PKC à la manière du DAG, est, à doses élevées, un promoteur de tumeurs. La palmitoylcarnitine est, par contre, un inhibiteur endogène de la PKC. Des produits comme la staurosporine et le balanol inhibent également la PKC
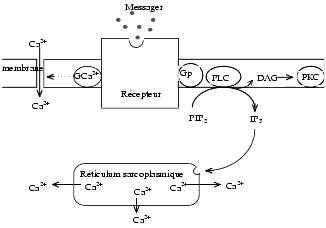
L’IP3 diffuse dans le cytoplasme, active un récepteur-canal homotétramérique du réticulum endoplasmique qui s’ouvre et libère du calcium dans le cytoplasme (Voir « Calcium, inhibiteurs calciques, strontium ».). Le calcium lui-même module l’ouverture de ce récepteur canal. L’élévation du Ca2+ libre intracytoplasmique entraîne l’activation d’un certain nombre de processus Ca2+-dépendants, comme l’activation de la calmoduline qui possède quatre sites de fixation des ions Ca2+. Le complexe Ca2+/calmoduline peut activer un très grand nombre d’enzymes qui ne sont pas toutes présentes dans chaque cellule et parmi lesquelles on peut citer la MLCK (myosin light chain kinase), ce qui augmente la contraction des muscles lisses, l’AMPc phosphodiestérase, la GMPc phosphodiestérase, la phospholipase A2, la phosphorylase kinase, certaines ATPases, la tyrosine et la phénylalanine hydroxylases.
Un des métabolites de l’IP3, l’IP4 aurait un effet opposé à celui de l’IP3.
Les protéines kinases régulent la synthèse et la libération des médiateurs, la sensibilité des récepteurs (désensibilisation), l’ouverture des canaux ioniques. La PKA et la PKC peuvent phosphoryler des récepteurs membranaires et moduler leur activité. Elles peuvent phosphoryler des protéines cytoplasmiques intervenant dans les voies de signalisation de la transcription des gènes… Ainsi la PKA et la PKC modulent, en sens opposé, l’activité de la protéine Raf qui est une sérine/thréonine kinase intervenant dans la voie mitogénique MAPK.
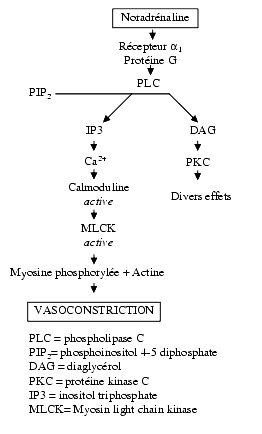
A titre d’exemple, l’effet a1-vaso-constricteur de la noradrénaline fait intervenir la phospho-inositidase ou PLC.
La noradrénaline entraîne une contraction des vaisseaux en activant les récepteurs a1, les protéines Gp, la phospholipase C, l’inositol triphosphate, IP3, le calcium, la calmoduline qui active la MLCK qui, elle-même, phosphoryle la myosine. La myosine phosphorylée se combine à l’actine entraînant la contraction. La myosine non phosphorylée ne se combine pas à l’actine, ce qui entraîne une relaxation.
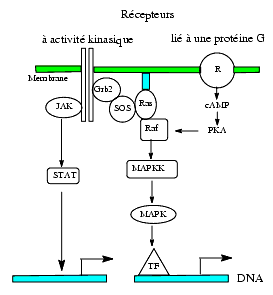
Effets nucléaires ou génomiques par stimulation de récepteurs membranaires
Les effets que nous avons décrits jusqu’a présent étaient essentiellement cytoplasmiques mais divers messagers comme l’insuline, les cytokines et divers facteurs de croissance, agissant surtout par l’intermédiaire de récepteurs -enzymes tyrosine kinases mais aussi de récepteurs liés aux protéines G, peuvent, sans pénétrer dans la cellule, avoir des effets nucléaires. Ils agissent par l’intermédiaire d’une cascade de réactions impliquant généralement des phosphorylations conduisant à l’activation de protéines qui modifient la transcription et la replication du DNA.
Nous indiquons ici les principales voies de signalisation:
- voie JAK-STAT où les protéines JAK (ou Janus kinases) situées au contact du récepteur sont phosphorylées et phosphorylent les protéines STAT, (signal transducer and activator of transcription) qui, après phosphorylation, se dimérisent et pénètrent elles-mêmes dans le noyau où elles activent la transcription
- voie Ras / MAPK (mitogen activated protein kinase) qui conduit à des modifications transcriptionnelles qui favorisent la division cellulaire (mitogène). C’est une voie complexe où interviennent successivement des protéines désignées par des sigles et parfois des chiffres qui ne sont généralement pas évocateurs de leur rôle. Les étapes essentielles de la mise en jeu de la voie Ras/MAPK sont les suivantes : le messager se lie à la partie extracellulaire d’un récepteur membranaire, par exemple le récepteur de l’insuline ou celui du PDGF (platelet derived growth factor) qui se dimérise et, par activité tyrosine kinase, est phosphorylé ; le récepteur interagit alors avec le domaine SH2 de la protéine Grb2 (growth factor receptor bound) qui, phosphorylée, interagit par son domaine SH3 avec la protéine SOS (son of sevenless) qui est phosphorylée. Cette dernière active la protéine Ras (après maturation post-translationnelle par farnésylation) qui de Ras-GDP inactive devient Ras-GTP active. Le Ras-GTP, par activité sérine/thréonine kinase, phosphoryle et active le Raf. Ce dernier active le MAPKK (mitogen-activated protein kinase kinase) qui, par phosphorylation, active des facteurs transcriptionnels tels que C-Myc, C-Jun, C-Fos.
- voie NF-AT (nuclear factor of activated T cells) qui est inhibée par la ciclosporine (Voir « Ciclosporine ».).
- voie NF-kB qui est un facteur nucléaire présent dans le cytoplasme sous forme inactive de deux protéines P450 et p65 liées à un facteur inhibiteur appelé IkB. La phosphorylation du facteur inhibiteur IkB sous l’influence de divers stimuli libère les deux protéines qui pénètrent dans le noyau et provoquent la transcription des mRNA codant pour plusieurs molécules proinflammatoires. Les glucocorticoïdes, sous forme liée à leur récepteur cytoplasmique, se fixent au NF-kB, c’est-à-dire aux protéines p50 et p65, les empêchant ainsi de pénétrer dans le noyau et d’activer la transcription de facteurs proinflammatoires.
- voie CREB (cyclic AMP responsive element binding protein). L’AMP cyclique interagit avec la protéine kinase A (PKA), laquelle active la protéine CREB qui se lie à l’élément de réponse correspondant du gène pour moduler sa transcription.
- Voie Smad: les protéines Smad, découvertes à partir d’expériences de génétique chez la drosophile, sont impliquées dans la transduction du signal après activation des récepteurs transmembranaires sérine/thréonine kinases qui phosphorylent des protéines Smad. Les protéines Smad phosphorylées migrent dans le noyau et forment des complexes avec des facteurs transcriptionnels de type Fast-1 qui modulent la transcription génique. Les messagers connus pour activer la voie Smad sont le TGF-b (transforming growth factor ß) et l’activine.
L’activation de plusieurs voies de signalisation aboutit à la formation de protéines AP-1 (activator protein), constituées d’un dimère Jun-Fos par liaison leucine, dimère jouant le rôle de facteur transcriptionnel au niveau du DNA.
Récepteurs intracellulaires
Parmi les messagers qui entraînent des effets nucléaires ou génomiques, notamment une modification de la transcription du DNA en RNA, on peut distinguer ceux qui agissent en pénétrant eux-mêmes dans la cellule – et on peut considérer qu’ils ont un effet direct – et ceux qui agissent sans y pénétrer – et on peut considérer qu’ils ont un effet indirect.
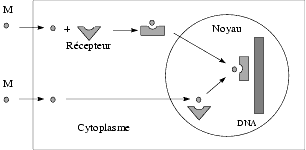
Les messagers à effet direct sont les hormones stéroïdes, testostérone, estradiol, progestérone, cortisone, aldostérone, l’hormone thyroïdienne, la vitamine D, qui est en réalité une hormone, et les rétinoïdes. Après pénétration dans la cellule, ils se lient à une protéine intracellulaire, appelée récepteur, dont ils modifient la conformation pour qu’elle puisse interagir, au niveau nucléaire, avec le DNA.
Le messager, en raison de son caractère lipophile, traverse la membrane plasmique et interagit soit avec le récepteur présent dans le cytoplasme et c’est le complexe messager-récepteur qui pénètre dans le noyau et se lie au DNA, soit avec le récepteur présent dans le noyau et c’est le complexe formé qui interagit avec le DNA. En réalité, le complexe messager-récepteur se dimérise avant d’interagir avec le DNA (cette dimérisation n’est pas indiquée sur le schéma qui suit).
La partie du récepteur qui, après activation par l’hormone, se lie au DNA, a une structure dite en doigts de zinc car les atomes de zinc par leurs liaisons avec des résidus histidine et cystéine lui donnent une forme de doigts.
La partie du DNA où le complexe hormone-récepteur se fixe est désignée par HRE (hormone response element).
La conséquence de l’interaction entre le complexe récepteur-messager et la partie régulatrice du gène est soit une activation soit une inhibition de la transcription du DNA en mRNA qui commande la biosynthèse des protéines correspondantes mais aussi en RNA de transfert ou tRNA et en RNA ribosomique ou rRNA.
Ce rappel sommaire des voies de signalisation montre leur complexité. Des applications pharmacologiques découlant de la modulation de ces voies sont prévisibles mais elles nécessitent de trouver des médicaments dont l’activité sur une cible particulière soit suffisamment spécifique pour ne pas entraîner trop d’effets indésirables.