Les complexes de platine sont aujourd’hui parmi les antinéoplasiques les plus efficaces et les plus utilisés en dépit de leurs effets indésirables reconnus.
La découverte des propriétés antitumorales du platine a été fortuite. En 1965, Rosenberg a observé une inhibition de la croissance d’Escherichia coli lorsque le milieu de culture contenait du chlorure d’ammonium et qu’il était soumis à un courant électrique établi entre deux électrodes de platine. Il montra que l’effet inhibiteur n’était pas dû au courant parcourant le milieu de culture mais à la formation d’un complexe entre le platine libéré par les électrodes et les molécules d’ammoniac et de chlorure du bain, c’est-à-dire par formation de dichlorodiamine-platine, produit connu depuis 1845.
Cette observation conduisit Rosenberg a étudier le cis-platine ainsi que d’autres complexes du platine et à mettre en évidence leur effet antinéoplasique chez l’animal puis chez l’homme. L’efficacité du cis-platine dans le traitement du cancer du testicule a été rapidement démontrée et largement confirmée depuis.
Structure des complexes
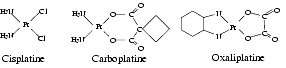
Le platine est un élément de masse atomique 196. Les rayons ioniques du platine II et IV sont respectivement de 0,80 Angström et 0,65 Angström. Le platine n’est pas utilisé en thérapeutique sous forme élémentaire mais sous la forme de complexes organométalliques. Le premier complexe introduit en thérapeutique a été le cis-platine, suivi par le carboplatine. Depuis lors, de nombreux autres complexes de platine ayant des propriétés antitumorales ont été synthétisés. Les trois complexes actuellement commercialisés en France sont, outre le cis-platine, le carboplatine et l’oxaliplatine.
Les complexes de platine actifs comme antinéoplasiques ont une structure commune : le platine, généralement à l’état II, Pt2+, est lié par des liaisons covalentes à quatre substituants, dont deux substituants azotés peu labiles et deux substituants labiles, chlorure ou oxygène.
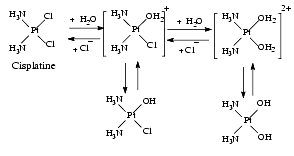
L’ensemble forme une structure plane carrée au centre de laquelle se trouve le platine. En milieu aqueux et en présence de chlorure, on a l’équilibre suivant :
Du fait de la structure plane du complexe, le platine est en contact de part et d’autre du plan avec les molécules environnantes. Si ces molécules sont nucléophiles, c’est-à-dire ont beaucoup d’affinité pour les sites chargés positivement comme l’est le platine, elles tendent à former avec lui de nouvelles liaisons covalentes, ce qui entraîne le départ des substituants labiles Cl ou OH. La forme hydratée, dite aqua, est beaucoup plus réactive que la forme chlorure.
Le platine se fixe par des liaisons covalentes aux molécules qu’il rencontre, notamment au DNA. Il se lie aux atomes d’azote des nucléotides formant le DNA, atomes d’azote N7 et N1 de l’adénine, N3 de la cytidine et N7 de la guanine.
Lorsqu’il établit deux liaisons, elles peuvent se faire avec la même base ou avec deux bases différentes situées soit sur le même brin de DNA, soit sur l’un et l’autre brin de DNA. L’établissement de ces liaisons avec formation d’adduits, perturbe la replication et la transcription du DNA.
Le platine se fixe par des liaisons covalentes à d’autres molécules que le DNA, notamment celles qui comportent des atomes de soufre, notamment la méthionine.
Pharmacocinétique
Les complexes de platine s’administrent en perfusion intraveineuse. Ils diffusent dans les tissus et s’éliminent essentiellement par le rein.
Le cis-platine dans le plasma riche en chlorure est essentiellement sous la forme bichlorure. Une fois qu’il a pénétré dans les cellules où la concentration de chlorure est beaucoup plus faible, il se transforme en dérivé monohydraté ou bihydraté, dérivés aqua très réactifs, qui attaquent le DNA. Pour réduire la toxicité rénale du cis-platine, on augmente la diurèse qui accélère son élimination et on maintient une concentration élevée de chlorure pour éviter sa transformation en dérivés hydratés.
Les autres dérivés comme le carboplatine et l’oxaliplatine donnent dans les milieux biologiques des dérivés mono-hydratés et bishydratés qui sont très réactifs.
Le carboplatine et l’oxaliplatine sont moins toxiques pour le rein que le cisplatine mais le carboplatine est plus toxique que lui sur le plan hématologique et l’oxaliplatine sur le plan neurologique, car leur distribution tissulaire est probablement différente.
La pharmacocinétique des complexes du platine, surtout aux faibles concentrations, était relativement mal connue car la méthode utilisée pour le doser, la spectrométrie d’absorption atomique avec four graphite, n’est pas suffisamment sensible et, d’autre part, ne permet pas de séparer les » métabolites » formés.
Utilisation
Les complexes de platine sont actuellement largement utilisés en cancérologie dans le traitement des tumeurs du testicule, de l’ovaire, de l’utérus et dans celui des cancers de la sphère ORL.
Ils sont utilisés parfois seuls, mais le plus souvent associés à un ou deux autres antinéoplasiques, dans ce cas il s’agit d’une polychimiothérapie.
Les complexes de platine ont plusieurs effets indésirables :
- Insuffisance rénale particulièrement importante avec le cis-platine et que l’on essaie de réduire en maintenant une diurèse importante avec, éventuellement, adjonction de chlorure de sodium. Myélotoxicité avec thrombopénie, leucopénie, anémie, plus importante avec le paraplatine qu’avec le cis-platine.
- Troubles neurosensoriels : ototoxicité, bourdonnements d’oreilles, diminution de l’acuité auditive, et surtout neuropathies périphériques qui sont fréquentes avec l’oxaliplatine.
- Troubles digestifs, vomissements, nausées lors de leur administration.
- Diminution de la concentration plasmatique de magnésium, de calcium et de potassium.
Enfin une résistance des tumeurs aux dérivés du platine peut apparaître. On l’explique par une moindre concentration des dérivés du platine dans les cellules néoplasiques, l’augmentation de glutathion intracellulaire et une augmentation de la capacité de réparation du DNA par les cellules et une augmentation des métallothionéines.
- Précédent
- Suivant