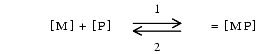Le médicament dans le sang
Équilibre entre compartiments
A l’état d’équilibre, à une concentration plasmatique donnée d’un médicament correspond une concentration tissulaire déterminée, c’est-à-dire que le sang est le reflet de ce qui se passe dans l’ensemble de l’organisme, bien que les concentrations atteintes dans les différents tissus soient généralement différentes.
La mesure de la concentration plasmatique permet une surveillance des traitements en évitant les concentrations toxiques ou inefficaces, à condition que la prise de sang pour le dosage soit effectuée à un moment bien déterminé après l’administration du médicament pour obtenir des résultats comparables.
En toute rigueur, dans l’équilibre plasma/tissus, il ne faudrait tenir compte que de la fraction libre du médicament, c’est-à-dire la fraction diffusible. Cependant, le rapport forme liée sur forme libre est généralement constant et la mesure de la concentration totale du médicament est suffisante pour la surveillance thérapeutique.
On a ainsi déterminé pour un certain nombre de médicaments des concentrations plasmatiques souhaitables, inférieures aux concentrations toxiques et suffisantes pour être efficaces. Entre ces deux limites, on a la zone thérapeutique.
Fixation aux protéines
Dans le sang les médicaments peuvent se fixer réversiblement aux protéines. La concentration des protéines dans le plasma est normalement de 60 à 70 g/L. Certaines protéines plasmatiques jouent un rôle dans la fixation des médicaments :
- L’albumine dont le poids moléculaire est de 68 000. Elle est formée d’une chaîne polypeptidique avec de nombreux ponts disulfures. Sa demi-vie est de l’ordre de trois semaines. Elle fixe surtout les médicaments acides tels que les anti-inflammatoires non stéroïdiens, certains hypolipémiants et les molécules endogènes comme les acides gras, la thyroxine et l’estradiol. Outre son rôle dans le transport de substances endogènes et de médicaments, elle assure pour l’essentiel la pression oncotique intravasculaire et s’oppose à la fuite hydrique extravasculaire . En cas d’hypoalbuminurie sévère, inférieure à 20 g/L, il est nécessaire de corriger le déficit en administrant de l’albumine qui, pour le moment, est obtenue à partir du sang humain.
- L’a1-glycoprotéine acide ou orosomucoïde, très riche en glucides et en acide sialique qui lui donnent un caractère acide. Elle fixe surtout les molécules basiques comme la lidocaïne, la prazosine.
- Les lipoprotéines qui fixent certains médicaments comme la chlorpromazine et l’imipramine.
- Les immunoglobulines comme les IgG dont la concentration plasmatique se situe autour de 15 g par litre.
Les éléments figurés du sang, notamment les érythrocytes lorsqu’ils fixent ou captent certains médicaments, jouent un rôle analogue aux protéines.
La liaison médicament/protéine dépend de plusieurs facteurs :
- L’affinité du médicament pour les sites de liaison sur les protéines. La fixation peut aller de 0 à près de 100%. La fixation des anti-inflammatoires comme l’indométhacine, de certains antidépresseurs comme l’imipramine, est supérieure à 95%. La fixation du phénobarbital, de la théophylline est de l’ordre de 50%. La fixation de l’isoniazide, du paracétamol est négligeable.
- La quantité de protéines qui peut varier en fonction de l’état physiologique ou pathologique. Par exemple, l’immobilisation, le repos au lit, les traumatismes, les brûlures, la grossesse, les cirrhoses la diminuent alors que les syndromes néphrotiques, l’anxiété l’augmentent.
- La concentration du médicament : si un médicament est présent en concentration suffisante pour saturer ses sites de fixation, tout nouvel apport se passe comme si la fixation n’existait pas.
- La compétition entre le médicament et une autre molécule :
- compétition entre deux médicaments pour un même site, l’un peut déplacer l’autre : l’acide salicylique déplace l’indométhacine, le clofibrate déplace les antivitamines K. Le médicament déplacé peut agir et donner des effets mais il est aussi rapidement métabolisé et éliminé.
- compétition entre un médicament et un produit endogène : les acides gras et la bilirubine qui sont aussi fixés par l’albumine entrent en compétition avec les médicaments acides.
La caractéristique essentielle de la liaison des médicaments aux protéines est d’être réversible selon la réaction suivante où M désigne le médicament, P, la protéine et MP le médicament lié à la protéine.
- Il y a équilibre entre la forme libre et la forme liée : lorsque la concentration de M augmente, la réaction s’effectue dans le sens 1 et lorsqu’elle diminue, dans le sens 2.
- Seule la forme libre [M] est active. Elle diffuse à travers les membranes et l’équilibre entre les compartiments s’établit en fonction de sa concentration. Elle est également celle qui s’élimine et est métabolisée.
- La forme liée [MP] peut être considérée comme un tampon, une forme de réserve qui ne traverse pas les membranes.
- La fixation d’un médicament aux protéines réduit sa dialysance et par conséquent l’efficacité de la dialyse utilisée comme moyen d’épuration au cours d’une intoxication.
Distribution tissulaire
Le médicament diffuse dans l’ensemble de l’organisme à partir du plasma. La distribution dépend du médicament et des tissus.
- Médicament : de sa concentration plasmatique sous forme libre et de ses caractéristiques physico-chimiques, en particulier de sa liposolubilité.
- Tissu ou organe : de l’existence de membranes spécifiques à franchir, de l’importance de l’irrigation (débit sanguin) et de la composition qui est à l’origine de l’affinité plus ou moins grande pour tel produit. Ainsi le tissu cérébral riche en lipides a une grande affinité pour les molécules liposolubles.
Ces caractéristiques expliquent que le médicament se distribue en général d’une manière non homogène dans les divers organes. Par exemple, la chloroquine se trouve à une concentration 700 fois plus élevée dans le foie que dans le plasma.
Passage dans le système nerveux central et le liquide céphalorachidien
Le système nerveux central pèse 2% du poids du corps, reçoit 16% du débit cardiaque (cerveau : 0,5 ml sang/g/minute, muscle au repos : 0,05 ml sang/g/minute). La substance blanche est moins bien irriguée que la grise.
En dépit de cette excellente irrigation, un certain nombre de substances ne pénètrent pas dans le cerveau. La membrane des capillaires cérébraux est doublée par un tissu de soutien glial, les astrocytes, créant ainsi une double barrière – endothélium capillaire et membrane gliale – peu perméable aux molécules non liposolubles. Les lésions possibles de la barrière, en cas d’anoxie notamment, sont susceptibles d’altérer sa perméabilité.
Les molécules liposolubles (non ionisées) et les gaz, par exemple les anesthésiques volatils, pénètrent facilement dans le cerveau par diffusion passive.
Les molécules polaires (ionisées) ne pénètrent pas ou peu par diffusion passive. L’atropine, par exemple, passe, mais sa forme quaternaire chargée positivement ne pénètre pas. La pénicilline ne pénètre pas.
Diverses substances à caractère polaire, ions, sucres, acides aminés et même certains peptides comme l’insuline, franchissent la barrière hémato-encéphalique en utilisant des transporteurs endogènes. Il s’agit d’un transport actif secondaire. On peut citer quelques uns de ces transporteurs :
- Glut-1, transporteur de glucose non dépendant de l’insuline, qui peut aussi faire pénétrer certaines glycopeptides
- le système LNA (large neutral aminoacids) qui permet l’entrée de certains acides aminés et de médicaments ayant une structure similaire comme la L-Dopa, le melphalan, la gabapentine, le baclofène
- des transporteurs de peptides comme la leucine enképhaline
- des récepteurs, comme celui de la transferrine qui est internalisé par endocytose.
Par ailleurs, certaines substances comme la bradykinine distendent les jonctions serrées (tight junction) intercellulaires et facilitent le passage de diverses substances à travers la barrière hémato-encéphalique.
Le passage d’un médicament du cerveau vers les organes périphériques est appelé redistribution. Un médicament comme le thiopental qui est très liposoluble, après administration intraveineuse pénètre très vite dans le cerveau, riche en lipides et bien irrigué, où sa concentration est rapidement maximum. Dans un deuxième temps, les autres tissus graisseux moins bien irrigués que le cerveau fixent le thiopental, entraînant un déplacement du produit du cerveau vers le sang et les tissus graisseux périphériques. Cette redistribution explique que le thiopental agit très rapidement et que sa durée d’action est courte.
Le liquide céphalorachidien sécrété par les plexus choroïdes a un volume d’environ 150 à 200 ml. Sa vitesse de renouvellement est d’environ 0,5 ml/minute. A l’état normal il ne contient pas de protéines. La concentration d’un médicament qui diffuse passivement dans le liquide céphalorachidien est, au mieux, égale à la concentration de sa forme libre dans le plasma.
Modifications de la distribution tissulaire
La distribution d’un médicament dans certaines parties de l’organisme ou d’un tissu peut être modifiée dans des conditions pathologiques, notamment en cas de troubles circulatoires.
La distribution peut également être modifiée volontairement par électroporation. L’électroporation est une technique qui consiste à soumettre les tissus à des impulsions de champ électrique qui augmentent la perméabilité de la membrane plasmique par ouverture de pores. On l’appelle électrochimiothérapie lorsqu’elle est utilisée en cancérologie. La faible pénétration des médicaments, notamment des antitumoraux, dans les cellules limite leur activité. Pour favoriser la pénétration de certains antinéoplasiques dans les tissus, on peut les administrer par voie générale et soumettre la zone à traiter à des impulsions de champ électrique suffisantes pour altérer les membranes plasmiques et les rendre perméables aux médicaments. L’électrochimiothérapie a été appliquée au traitement du mélanome où la bléomycine était administrée par voie intraveineuse et les impulsions électriques appliquées au niveau des tissus atteints.