L’organisme limite l’extension des réactions radicalaires par des réactions enzymatiques, par piégeage des métaux et par des molécules appelées anti-oxydants susceptibles de piéger les radicaux libres sous une forme peu réactive.
Enzymes réduisant la concentration de O2- et HOOH
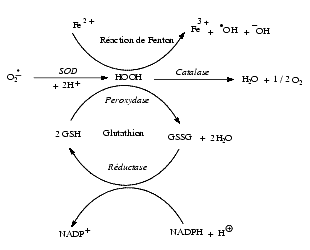
La superoxyde dismutase, ou SOD, catalyse la transformation de deux ions superoxyde en eau oxygénée :
![]()
La transformation du radical superoxyde en H2O2 peut s’effectuer spontanément mais l’enzyme l’accélère environ 10 000 fois. L’enzyme SOD est inductible, sa biosynthèse est augmentée par l’hyperoxygénation et par certains toxiques comme le paraquat.
La catalase, présente dans le cytosol mais pas dans les mitochondries, détruit l’eau oxygénée et évite ainsi la formation de radicaux ![]() OH.
OH.
La glutathion peroxydase, enzyme à sélénium présente à la fois dans le cytosol et la mitochondrie, détruit l’eau oxygénée HOOH et les hydroperoxydes ROOH.
Le maintien de l’activité de la glutathion peroxydase nécessite la régénération du glutathion réduit GSH qui est assuré par la glutathion réductase à partir du NADPH réduit qui est régénéré par la voie des pentoses.
La superoxyde dismutase a un effet protecteur contre les réactions radicalaires dans la mesure où la catalase et la glutathion peroxydase sont suffisantes pour détruire le H2O2 formé. Dans le cas contraire l’excès de H2O2, surtout en présence de métaux, conduit à la formation des radicaux OH, extrêmement toxiques, selon la réaction :
La consommation de glutathion réduit provoqué par le fonctionnement de la glutathion péroxydase lorsqu’il n’est pas compensé par la glutathion réductase – qui nécessite un apport NADPH – crée un déficit cellulaire en glutathion et en groupe R-SH. Ce déficit en groupe R-SH est à l’origine d’une augmentation du calcium intracellulaire par inhibition de sa sortie hors de la cellule et de l’inhibition de son repompage par le réticulum sarcoplasmique (voir schéma).
Par ailleurs les enzymes lipolytiques comme la phospholipase A2 pourraient débarrasser la cellule des hydroperoxides lipidiques et les enzymes protéolytiques élimineraient une partie des protéines altérées par peroxydation.
Molécules réduisant la disponibilité des métaux
Les métaux sont rarement à l’état libre dans l’organisme. Liés à différentes molécules organiques, transferrine, ferritine, céruloplasmine, ils perdent partiellement ou totalement leur activité de stimulation des réactions radicalaires.
Pour favoriser la formation du radical ![]() OH, le cuivre et le fer doivent être à l’état cuivreux Cu+ et ferreux Fe2+, leur oxydation diminue leur toxicité. Ainsi la céruloplasmine en catalysant l’oxydation du fer, réduit sa toxicité.
OH, le cuivre et le fer doivent être à l’état cuivreux Cu+ et ferreux Fe2+, leur oxydation diminue leur toxicité. Ainsi la céruloplasmine en catalysant l’oxydation du fer, réduit sa toxicité.
4 Fe2+ + 2 + 4 H → 4 Fe3+ + 2 H2O
Une augmentation de la synthèse de métallothionéines, protéines qui fixent les métaux, joue aussi un rôle protecteur contre la toxicité des radicaux libres mais peut aussi protéger les tumeurs ; celles qui sont riches en métalloprotéines sont peu sensibles aux traitements antinéoplasiques.
Divers chélateurs, notamment la déféroxamine, ont donné dans la protection contre les radicaux libres des résultats intéressants in vitro, mais rarement in vivo. La dexrazoxane, qui après pénétration dans le cytoplasme est hydrolysée en métabolites ayant des propriétés chélatrices, possède un effet protecteur contre la toxicité des anthracyclines où le fer joue un rôle déterminant (Voir « Chélateurs utilisés en thérapeutique ».).
Antioxydants
Un certain nombre de substances s’opposent à la propagation des réactions radicalaires, très souvent en formant à partir d’un radical très réactif un autre radical beaucoup moins réactif. On les appelle antioxydants. Ils sont liposolubles ou hydrosolubles.
Antioxydants liposolubles
Les antioxydants liposolubles sont présents surtout dans les membranes. Ce sont la vitamine E, la vitamine A et les caroténoïdes.
- Le tocophérol ou vitamine E semble jouer ce rôle essentiel.
a-tocophérol-OH + LOO
 → a-tocophérol-O
→ a-tocophérol-O + LOOH
+ LOOH
a-tocophérol + LOO
+ LOO  → LOO-a-tocophérol
→ LOO-a-tocophérol - Les caroténoïdes et la vitamine A ont habituellement un effet antioxydant.
CAR + LOO![]() → LOO – CAR
→ LOO – CAR![]()
LOO – CAR![]() + LOO
+ LOO ![]() → LOO – CAR – OOL
→ LOO – CAR – OOL
- Les quinones, en particulier le coenzyme Q ou ubiquinome, et la bilirubine qui est le produit final de la dégradation du métabolisme de l’hème ont aussi un effet antioxydant.
Antioxydants hydrosolubles
- L’acide ascorbique a un effet antioxydant en régénérant l’a-tocophérol radical et un effet prooxidant en réduisant le fer ferrique Fe3+ en fer ferreux Fe2+ qui favorise la formation de radicaux
 OH à partir de H2O2.
OH à partir de H2O2. - Le glutathion, qui est un tripeptide glutamyl-cystéinyl-glycine dont la concentration intracellulaire est physiologiquement élevée, exerce un effet antioxydant, notamment en régénérant la vitamine E.
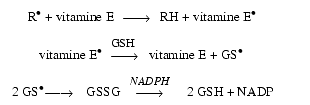
Le glutathion est nécessaire à l’activité de la glutathion peroxydase et à celle de la glutathion S-transférase qui catalyse la conjugaison des composés électrophiles. Le glutathion peut de plus interagir directement avec certains radicaux libres.
- L’acide urique, produit de dégradation des bases puriques, insoluble dans les lipides, peu soluble dans l’eau, exerce un effet antioxydant. Sa concentration est abaissée dans les noyaux gris centraux des parkinsoniens.
- Un certain nombre de médicaments à propriétés antioxydantes sont actuellement en cours d’étude.