Les agents de contraste iodés sont utilisés en radiologie pour explorer des cavités : vaisseaux, voies urinaires, voies biliaires, espaces sous-arachnoïdiens, arbre bronchique, cavité utérine. Dans la majorité des cas ils sont administrés par voie vasculaire et doivent être hydrosolubles. Les molécules iodées utilisées pour l’exploration radiologique possèdent un certain nombre de caractéristiques.
Pouvoir absorbant des rayons X
L’absorption des rayons X dépend de la composition de la matière. L’absorption croît avec le nombre d’électrons, c’est-à-dire le numéro atomique des atomes. L’atome d’iode, de masse 127, comporte 53 électrons, nombre beaucoup plus élevé que celui des atomes qui entrent dans la constitution de l’organisme, comme le carbone, l’hydrogène, l’oxygène, et l’azote. Les molécules iodées absorbent davantage les rayons X que les tissus à l’exception de l’os, créant ainsi un contraste d’absorption. Introduits dans les cavités, les agents de contraste iodés les rendent opaques aux rayons X.
L’absorption des rayons X croît avec le nombre d’atomes d’iode par unité de volume traversé. Pour augmenter l’absorption, on introduit plusieurs atomes d’iode par molécule, en général trois ou six, tout en augmentant le nombre de molécules iodées par unité de volume, c’est-à-dire la concentration de l’agent de contraste.
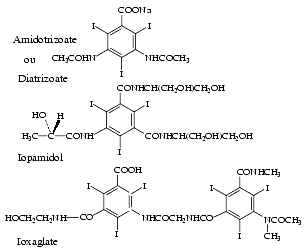
La structure chimique de quelques agents de contraste tri-iodés et hexa-iodés est indiquée ci-dessous.
Solubilité dans l’eau
La voie d’administration vasculaire, mode d’utilisation le plus fréquent, nécessite l’obtention d’agents hydrosolubles. Pour rendre une molécule iodée hydrosoluble, on greffe sur elle des substituants hydrophiles qui sont soit des acides RCOOH, ionisés à pH neutre en RCOO–, appelés agents anioniques, soit des polyols non ionisés comportant plusieurs groupes OH, comme les sucres de type R-(CHOH)n-CH2OH.
La différence entre ces deux types de préparations est que les produits ioniques peuvent être plus « irritants » que les non ioniques et surtout que les charges négatives RCOO– doivent être neutralisées par des cations, sodium ou méglumine, ce qui augmente leur osmolalité.
Osmolalité
L’osmolalité d’une solution est proportionnelle au nombre total de molécules et d’ions qu’elle contient. Comme pour obtenir un bon contraste radiologique il faut une grande quantité d’atomes d’iode par unité de volume exploré, c’est-à-dire un grand nombre de molécules contenant chacune plusieurs atomes d’iode, l’agent de contraste risque ainsi d’avoir une osmolalité beaucoup plus grande que celle du plasma. Etant hypertonique, il crée un appel d’eau à partir des cellules.
Pour réduire l’osmolalité de l’agent de contraste iodé, il faut réduire le nombre de molécules par unité de volume. Ceci peut être obtenu en utilisant des molécules de poids moléculaire plus élevé en formant, par exemple, à partir d’un monomère tri-iodé un dimère hexa-iodé.
Un agent de contraste ionique qui contient des cations sodium ou méglumine pour neutraliser ses charges négatives a une osmolalité plus grande qu’un agent non ionique identique par ailleurs.
Ces arguments montrent l’intérêt des molécules iodées non ioniques, de poids moléculaire élevé.
Viscosité
La viscosité représente la difficulté d’écoulement d’un produit dans un conduit ou encore la difficulté d’un liquide à s’adapter à un nouveau contenant. La viscosité augmente avec le poids moléculaire. Celle des dimères est plus élevée que celle des monomères.
Stabilité
L’atome d’iode des agents de contraste est lié à la molécule organique par une liaison covalente stable et il n’y a guère de libération d’iode à l’état libre dans l’organisme après leur administration.