Le chrome, Cr, ainsi que le molybdène et le tungstène appartiennent au groupe VIB de la classification périodique des éléments. Le numéro atomique du chrome est 17, sa structure électronique (Ar) 3d5, 4s1, la masse atomique de l’isotope le plus abondant 52, son rayon ionique sous la forme Cr3+, 0,63 A° et sous la forme Cr6+, 0,52 A°. Cette dernière forme est très réactive et n’existe pas à l’état libre. Voir Généralités Métaux.
Le chrome existe sous plusieurs états d’oxydo-réduction Cr° ou chrome métallique, le chrome bivalent Cr2+ par exemple dans Cr Cl2, le chrome trivalent CrCl3 ou Cr203, le chrome quadrivalent Cr032-, hexavalent Cr042-, comme le chromate de sodium Na2Cr04 et le bichromate K2Cr207.
Dans les minerais le chrome est présent dans sous la forme de chromite Fe0 Cr203 ou Mg0 Cr203.
Le chrome est largement utilisé en métallurgie.
Toxicocinétique
Absorption
Le chrome peut être absorbé par inhalation sous forme de poussière en suspension dans l’air et par ingestion.
Le chrome trivalent est faiblement absorbé par voie digestive, sa biodisponibilité serait de l’ordre de 1%.
Le chrome hexavalent traverse les membranes biologiques et est absorbé par le tube digestif non pas sous forme cationique, Cr6+, mais sous forme de chromate Cr042- et de bichromate Cr2042-. La struture du chromate ressemble à celle du sulfate, SO42-.
Distribution
La concentration du chrome dans les divers tissus de l’organisme est très faible : dans le plasma et dans le sang les concentrations normales sont situées entre 0,1 et 0,2 µg/L.
Elimination
Les voies d’iliminations du chrome sont mal connues. Il est éliminé principalement par voie biliaire, son élimination urinaire est faible, inférieure à 1µg/L.
Rôles
Physiologique
Le chrome est considéré comme un élément essentiel jouant le rôle de co-facteur favorisant l’action de l’insuline. Il faut cependant souligner que ce facteur n’a pas été isolé.
Toxique
Le chrome peut avoir un effet toxique : par inhalation il entraîne une altération des voies nasales (perforation de la cloison) des bronches et il favoriserait a long terme l’apparition de cancers et de pneumoconioses.
Le chrome hexavalent est beaucoup plus toxique que le chrome trivalent, la dose létale par ingestion est chez le rat de 5 mg/kg, il est très aggressif pour les tissus et provoque des lésions du tube digestif et des voies pulmonaires.
Le chrome sous forme de chromate, chrome VI pénétre dans les cellules en emprutant probablement les mécanismes de transport du sulfate et une fois à l’intérieur de la cellule il serait réduit en chrome trivalent, le chrome VI est un oxydant très puisant.
Le chrome en particulier Cr6+ peut être à l’origine de dermatoses de contact car il est en très réactif, il se combine à des protéines avec lesquelles il forme des haptènes à l’origine de réactions allergiques.
Le chrome réagit également avec les acides nucléiques dont il peut altérer le fonctionnement.
Traitement
Seules les mesures préventives sont efficaces.
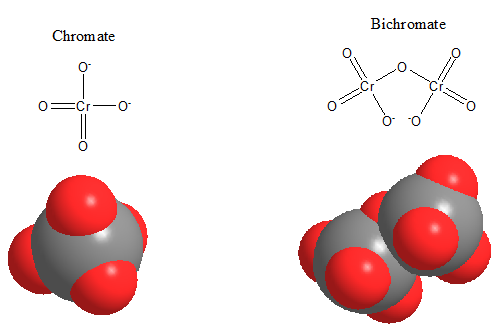
Structure de l’acide chromique

