L’eau constitue 60% du poids du corps, ce pourcentage varie de 55 chez l’obèse à 65 chez le sujet maigre. L’eau est répartie en 2 compartiments, l’un intracellulaire, environ 70%, et l’autre extracellulaire, environ 30%, ce dernier se subdivisant en liquide extravasculaire ou interstitiel et en liquide intravasculaire. Il y a relativement moins d’eau chez les obèses que chez les sujets normaux, ce qui modifie le volume de distribution des médicaments en fonction de leur caractère hydrosoluble ou liposoluble.
Plusieurs hormones interviennent dans la régulation du métabolisme de l’eau, mais c’est l’hormone antidiurétique qui joue le rôle essentiel, en favorisant sa réabsorption rénale. Un surdosage en hormone antidiurétique d’origine exogène ou une stimulation de sa sécrétion par des médicaments comme la carbamazépine, le chlorpropamide, certains psychotropes, peut entraîner une rétention excessive d’eau, à l’origine d’une dilution des substances qu’elle contient.
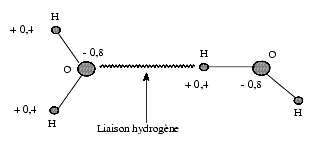
L’eau, H2O, est une molécule polaire, la charge partielle négative étant placée sur l’atome d’oxygène et la charge partielle positive répartie sur les deux atomes d’hydrogène. Ainsi l’eau, molécule neutre, forme un dipôle permanent.
Les molécules d’eau se lient entre elles par des liaisons hydrogène établies entre l’oxygène d’une molécule et l’hydrogène d’une autre molécule. Il s’agit d’une liaison hydrogène intermoléculaire dont l’énergie est de 4 kcal/mol, alors que celle d’une liaison covalente oxygène-hydrogène est de 110 kcal/mol. Chaque molécule d’eau peut établir jusqu’à 4 liaisons hydrogène à l’état solide, c’est-à-dire dans la glace. Dans l’eau le nombre moyen statistique de liaisons hydrogène est de 3,4 pour chaque molécule. Ces liaisons hydrogène expliquent que la température de vaporisation de l’eau soit aussi élevée, 100°C, pour une molécule d’aussi faible masse moléculaire.
L’eau pure est constituée de molécules de H2O mais aussi d’ions H+ et OH–. L’ion H+ ou proton, est hydraté et peut s’écrire H3O+ ou encore H9O4+ dans la mesure où la charge positive se répartit sur quatre molécules d’eau. L’ion OH– s’associe à trois molécules d’eau pour donner H7O4–. La constante d’ionisation Kd ou de dissociation de l’eau s’écrit :
L’eau de l’organisme contient diverses molécules inorganiques et organiques en solution ou en suspension.
Les molécules polaires, plus particulièrement les ions, sont solubles dans l’eau et sont appelées hydrophiles. Lorsqu’un ion est introduit dans l’eau, les molécules d’eau s’orientent autour de lui, les ions sont hydratés. Par exemple chaque ion sodium ou potassium est entouré de six molécules d’eau.
Les molécules non polaires sont insolubles dans l’eau et appelées hydrophobes. Elles sont souvent lipophiles. En milieu aqueux, les molécules lipophiles s’assemblent entre elles en agrégat, ce qui constitue l’effet hydrophobe, à l’origine de la formation des micelles, de la bicouche lipidique et de la structuration des protéines.
L’eau contient de nombreuses molécules, électrolytes, substances organiques, de poids moléculaire plus ou moins élevé, à l’origine de la pression osmotique ou osmolalité. A titre de référence une solution à 9 g de ClNa est iso-osmotique au plasma.
Les membranes cellulaires sont perméables à l’eau dont les mouvements dépendent des différences d’osmolalité de part et d’autre des membranes. Le transfert d’eau peut se faire par diffusion à travers la bicouche lipidique de la membrane plasmique mais ce transfert est lent et de faible importance. Le transfert d’eau se fait essentiellement par des canaux spécifiques (water channels) appelés aquaporines.
Les aquaporines sont des protéines qui viennent s’insérer dans la membrane plasmique des cellules. Elles sont formées de 4 monomères, ce sont des tétramères. Chaque monomère comporte un canal perméable aux molécules d’eau, dans les 2 sens, vers l’intérieur ou l’extérieur, selon le gradient osmotique .Les aquaporines ne laissent pas passer les ions, y compris le proton, car ils sont « hydratés ». Il existe une douzaine de variantes d’aquaporines appelées aquaporines-0 (AQP-0), aquaporine-1 (AQP-1)… jusqu’à aquaporine-10 (AQP-10). Elles sont perméables à l’eau et, de plus, certaines d’entre elles sont aussi perméables à de petites molécules comme le glycérol et l’urée et sont appelées aquaglycéroporines.
Les différents types d’aquaporines ne sont pas distribués d’une manière homogène dans les cellules de l’organisme. Les AQP-1 sont présentes surtout dans les globules rouges, au niveau du rein, des plexus choroïdes ; les AQP-2, au niveau du rein (tube collecteur) et régulées par la vasopressine, les AQP-4 dans le cerveau, les AQP-7 et les AQP-9 dans les adipocytes. L’ouverture et la fermeture de certains types d’aquaporines sont dépendantes du pH. Certaines contiennent des molécules de cystéine qui participent à leur activité et sont inhibées par les dérivés mercuriels.
Pour plus d’informations sur les aquaporines, voir : Aquaporin Water Channels.
- Précédent
- Suivant
