Métabolisme
Synthèse
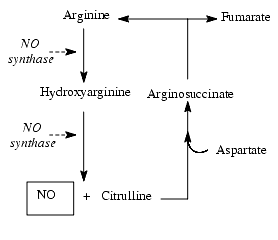
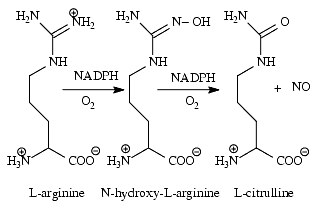
La synthèse de NO s’effectue à partir de la L-arginine grâce à la NO-synthase, enzyme héminique dont la structure ressemble à celle du cytochrome P-450. En présence de NADPH (nicotinamide adénine dinucléotide phosphate), d’oxygène, de fer, de tétrahydrobioptérine, de FAD (flavine adénine dinucléotide) et de FMN (flavine mononucléotide), la NO-synthase, NOS, transforme l’arginine en hydroxyarginine qui, après réduction, est transformée en NO et citrulline selon la réaction :
La citrulline, en présence de l’arginosuccinate synthéthase et d’aspartate, est transformée en arginosuccinate, puis en fumarate et arginine. L’arginine provient ainsi d’un renouvellement endogène et d’un apport exogène, alimentaire.
On distingue trois types d’isoenzymes NO-synthases : l’isoenzyme de type I, présente dans les neurones et les cellules épithéliales, l’isoenzyme de type II, présente dans différents types de cellules, dont les macrophages, après induction par les cytokines, et l’isoenzyme de type III, présente essentiellement dans les cellules endothéliales.
Les NO-synthases de type I et III sont constitutives. Elles sont présentes spontanément dans les cellules endothéliales et appelées eNOS et et les neurones et appelées nNOS. Elles sont activées par le complexe Ca2+/calmoduline et entraînent une libération de NO immédiate et de courte durée. Une partie de l’isoenzyme de l’endothélium se fixe par palmitoylation à des invaginations de la membrane plasmique appelées caveolae qui libèrent une substance appelée cavéoline susceptible d’inhiber l’activité de l’enzyme tandis que la calmoduline associée au calcium l’active.
La NO-synthase inductible de type II, appelée iNOS, apparaît dans les macrophages, les neutrophiles et les hépatocytes sous l’influence de cytokines, notamment l’interleukine-1, du Tumor Necrosis Factor, de l’interféron gamma et de lipopolyssaccharides. L’induction de cette NO-synthase par effet génomique nécessite un délai de plusieurs heures mais la NO-synthase induite est immédiatement active après sa synthèse, en absence de calcium, et entraîne une libération prolongée et très importante de NO. Sa synthèse est inhibée par les glucocorticoïdes.
Plusieurs dérivés de l’arginine, comme la monométhyl-L-arginine qui est présente dans le plasma de malades insuffisants rénaux, sont des inhibiteurs des NO-synthases.
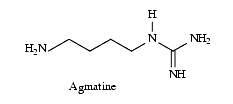
- L’arginine par décarboxylation sous l’influence de l’arginine décarboxylase est aussi à l’origine de l’agmatine que l’on trouve dans divers tissus, en particulier le cerveau. L’agmatine paraît avoir les caractéristiques d’un médiateur, elle s’oppose à la dépendance et à la tolérance morphinique et à certaines formes d’hyperalgie. Elle inhibe également la NO-synthase. Elle est métabolisée par l’agmatinase qui la transforme en putrescine et la diamine oxydase qui la transforme en acide guanido-butanoïque.
-
Libération
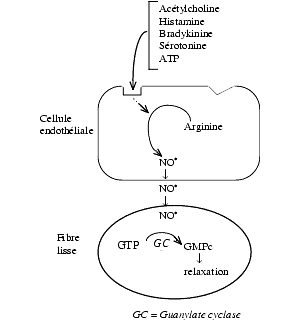
Dès sa synthèse, le NO diffuse sous forme gazeuse; synthèse et libération sont simultanées et il n’y a pas de stockage de NO dans les tissus. Il y a une libération basale continue de NO qui, par la vasodilatation qu’il exerce, participerait à la régulation de la pression artérielle. Les mécanismes régulant la synthèse de NO sont complexes:
- Des médiateurs comme l’acétylcholine, l’histamine, la sérotonine, l’adénosine, la bradykinine, le glutamate activent la NO-synthase constitutive, déjà présente dans la cellule. Ainsi l’acétylcholine active des récepteurs muscariniques liés aux protéines G qui, par l’intermédiaire de la phospholipase C et la formation d’IP3, provoquent une augmentation du calcium intracellulaire, lequel en s’associant à la calmoduline active la NO-synthase.
- Des cytokines, le TNFa (tumor necrosis factor a) l’interleukine-I, l’interféron-g agissent en déclenchant la synthèse des NO-synthases inductibles. L’hypotension observée au cours de certains chocs septiques et au cours de certaines cirrhoses proviendrait d’une libération excessive de NO.
- La formation directe de NO, sans intervention enzymatique, est également possible à partir du nitrite lorsque le pH du milieu est acide comme lors de l’ischémie.
Le NO diffuse à travers les membranes et pénètre dans toutes les cellules voisines de celles qui le libèrent. Libéré par l’endothélium vasculaire, il pénètre dans les fibres vasculaires lisses. Libéré par les terminaisons présynaptiques neuronales, il diffuse dans les éléments postsynaptiques et, d’une manière rétrograde, dans les terminaisons présynaptiques qui l’ont libéré et augmente la libération de glutamate.
Le NO peut se trouver sous forme neutre NO (que l’on peut écrire NO· car il s’agit d’un radical, c’est-à-dire d’une molécule ayant un électron célibataire), sous forme de cation NO+ par perte d’un électron, et sous forme d’anion NO– par gain d’un électron. Il peut ainsi se comporter en réducteur ou en oxydant.
Catabolisme
Le NO est une molécule gazeuse instable qui dans l’organisme est transformée spontanément, en raison de la présence d’oxygène, en nitrite NO2– puis en nitrate NO3–.
Il y a peu de temps encore, on pensait que le nitrate présent dans l’organisme était uniquement d’origine exogène, alimentaire. L’alimentation, surtout les végétaux, apporte de 30 à 200 mg de nitrate par jour. On sait maintenant qu’une partie du nitrate est d’origine endogène, sa production étant augmentée au cours des infections et lors de l’activation du système immunitaire. Elle est augmentée aussi d’une manière physiologique dans la deuxième partie du cycle menstruel sous l’influence de l’élévation de la concentration d’estradiol.
La cystéine pourrait protéger le NO en ralentissant son oxydation.
Effets
Le monoxyde d’azote NO, comme le monoxyde de carbone CO, a une grande affinité pour le fer; il module l’activité de diverses enzymes contenant du fer.
- Il active la guanylate cyclase, enzyme héminique (fer lié à des atomes d’azote) et hétérodimérique.
- Cette activation provoque la transformation du guanosine triphosphate, GTP, en guanosine mono-phosphate cyclique, GMP cyclique, dont l’augmentation est responsable de la modulation de l’activité de diverses protéines kinases qui, en favorisant la sortie de potassium et de calcium hors de la cellule, provoquent une hyperpolarisation ayant pour conséquence :
- une relaxation des fibres vasculaires lisses, c’est-à-dire la vasodilatation, y compris celles des corps caverneux lors de l’érection et celle des vaisseaux cérébraux lors de la migraine
- une bronchodilatation qui n’est pas cependant suffisamment importante pour justifier l’utilisation du NO dans le traitement des crises d’asthme
- un relâchement de l’estomac après le repas pour l’adapter au contenu alimentaire
- une inhibition de l’agrégation plaquettaire et de l’adhésion des plaquettes à l’endothélium.
- Il peut inhiber, sans que l’on sache l’importance des conséquences de cette inhibition, des enzymes non héminiques comportant un atome de fer lié à des atomes de soufre :
- Il intervient dans le métabolisme intracellulaire du fer par un mécanisme complexe. La biosynthèse des récepteurs de la transferrine, de la ferritine et de l’ALA synthase est régulée par une protéine intracytoplasmique IRP-1 (iron regulatory protein) qui en interagissant avec des séquences de mRNA appelées IRE (iron response elements) régulent la traduction (translation) des protéines précédentes. Un excès de NO se comporte comme une déficience intracytoplasmique en fer, stimule la biosynthèse des récepteurs de la transferrine et inhibe celle de ferritine et d’ALA synthase, ce qui entraîne une anémie. Le NO produit en excès au cours d’un état inflammatoire chronique pourrait ainsi être à l’origine d’une anémie dite de type inflammatoire.
- Le NO interagit avec un certain nombre de molécules autres que des enzymes :
- avec l’ion superoxyde O2 pour donner l’anion peroxynitrite ONOO– qui, après protonation, se décompose en radical ·OH et en radical dioxyde d’azote NO·2.
- avec l’hémoglobine : l’affinité du NO pour l’hémoglobine est 100 000 fois plus importante que celle de l’oxygène. Le NO transforme l’oxyhémoglobine en méthémoglobine et est parallèlement inactivé selon la réaction suivante :
Hb (Fe2+) O2 + NO ¾® Hb (Fe3+) + NO3–
Des études récentes montrent que l’hémoglobine peut servir de transporteur de NO. L’hémoglobine fixe le NO au niveau du poumon où elle est nitrosylée et le libère au cours du transit artérioveineux. - avec les groupes RSH qu’il transforme en R-S-NO ou nitrosothiol.
- Le NO module l’activité de différentes voies de signalisation conduisant à des effets génomiques.
- Par les précédents mécanismes, et sans doute d’autres non encore identifiés, le NO exerce divers effets encore à préciser : dans la mémorisation et la régulation du sommeil, dans la différenciation, la maturation et la mort cellulaire (apoptose), dans l’angiogenèse, l’inflammation et l’effet cytotoxique des lymphocytes et des macrophages.
Alors que le NO était considéré initialement comme n’ayant que des effets bénéfiques, les études ultérieures ont montré qu’une production endogène excessive de NO peut avoir des effets néfastes : par exemple, à concentration élevée, il provoque des lésions cérébrales, peut-être par libération excessive de glutamate responsable de l’ouverture de canaux cationiques. Il jouerait un rôle dans la genèse de la maladie de Parkinson et au cours du choc septique. L’excès de NO pourrait participer à l’altération des cellules ß du pancréas lors de l’installation du diabète. Il pourrait aussi stimuler le développement de certaines tumeurs ainsi que l’angiogenèse. L’anion peroxynitrite, ONOO–, peut altérer les membranes cellulaires, le DNA et le RNA. La présence de résidus nitro-tyrosine dans les protéines peut être considérée comme un marqueur de la production, peut-être excessive, de NO. Dès lors, des médicaments inhibiteurs de sa synthèse ou susceptibles de le neutraliser, comme les chélates de fer ou de cobalt, pourraient avoir des applications thérapeutiques.
- Le monoxyde de carbone CO qui ressemble au NO, notamment par son affinité pour le fer, est produit dans l’organisme à partir de l’hème, sous l’influence de l’hème oxygénase. Le CO endogène pourrait avoir un rôle qui reste à préciser.
- L’hydrogène sulfuré, SH2, est un gaz synthétisé par différentes cellules dont les cellules nerveuses sous l’influence de 2 enzymes, la cystathionine-g-lyase et la cystathionine-b-synthase à partir de la cystéine. Comme le NO, le SH2a un effet vasodilatateur mais son rôle physiopathologique reste à préciser.
Voir Chélateurs utilisés en thérapeutique.
Utilisation
Le monoxyde d’azote, dilué dans l’azote, est présenté en bouteilles de 5 et 20 litres remplies sous une pression de 200 bars. Il est utilisé par inhalation à très faible concentration, dilué dans un mélange air/oxygène. Il est indiqué dans le traitement de l’hypertension pulmonaire, en particulier l’hypertension artérielle pulmonaire néonatale et dans celui d’hypoxémies réfractaires au cours du syndrome de détresse respiratoire aiguë. Il a également un effet bronchodilatateur.
|
KINOX* Gaz pour inhalation |