Les effets de la noradrénaline et de l’adrénaline sont souvent désignés sous le terme adrénergiques et ceux de la dopamine sous le terme dopaminergiques.
La comparaison de l’activité de divers agonistes et divers antagonistes adrénergiques a conduit à distinguer plusieurs types de récepteurs responsables d’effets pharmacologiques spécifiques. On parlera indifféremment d’effets ou de récepteurs d’un type donné : a et ß (a1, a2, ß1, ß2, ß3) et dopaminergiques (D1, D2, D3, D4 et D5). Les données qui ont conduit à différencier ces types de récepteurs sont trop complexes pour pouvoir être exposées ici.
D’autres sous-classes de récepteurs ont été décrites dans la littérature, mais nous ne les aborderons pas car pour le moment il n’en découle pas d’applications thérapeutiques.
Le couplage des récepteurs adrénergiques s’effectue par l’intermédiaire des protéines G qui modulent l’activité de la phospholipase C et du calcium (récepteur a1) et de l’adénylcyclase qui peut être inhibée (récepteur a2) ou activée (récepteurs ß1, ß2, ß3).
Effets adrénergiques alpha et bêta
Effets périphériques
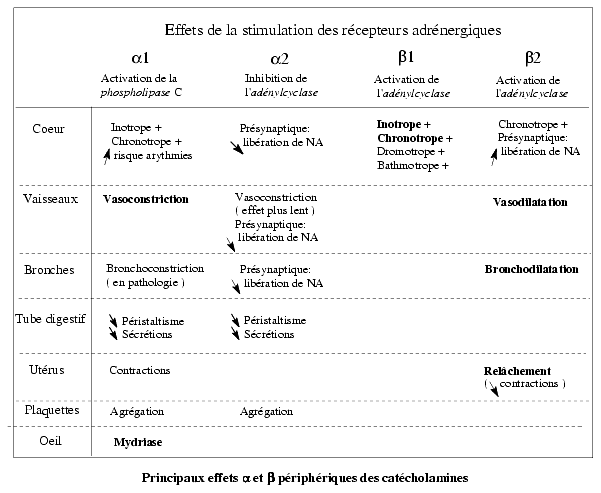
Les principaux effets adrénergiques périphériques de type a (a1, a2) et ß (ß1, ß2 et ß3) des catécholamines sont résumés dans le tableau qui suit.
- La stimulation des récepteurs a1 postsynaptiques se traduit essentiellement par une vasoconstriction, des contractions utérines, un effet pro-agrégant plaquettaire, une mydriase et une contraction du sphincter urétral.
- Les récepteurs a2 sont le plus souvent présynaptiques et leur stimulation se traduit par une diminution de la libération de noradrénaline. Il existe cependant des récepteurs a2 postsynaptiques qui favorisent l’agrégation plaquettaire.
- Les récepteurs ß1 sont postsynaptiques et localisés essentiellement au niveau du cœur. Leur stimulation se traduit par un effet inotrope positif (augmentation de la force de contraction), chronotrope positif (accélération du rythme), dromotrope positif (accélération de la conduction) et bathmotrope positif (augmentation de l’excitabilité).
- Les récepteurs ß2 sont essentiellement postsynaptiques. Leur stimulation entraîne une vasodilatation, une bronchodilatation, un relâchement de l’utérus et une stimulation cardiaque indiscutable mais moindre que celle de la stimulation ß1. On estime qu’il y a environ 80% de récepteurs ß1 et 20% de récepteurs ß2 au niveau du cœur. La stimulation des récepteurs ß2 augmente la captation de potassium par le muscle, ce qui peut entraîner une diminution de sa concentration plasmatique.
- Les récepteurs ß3 postsynaptiques présents au niveau des adipocytes sont responsables, par activation de l’adénylcyclase et formation d’AMP cyclique, de la lipolyse et d’une stimulation de la respiration mitochondriale avec dissipation de chaleur. Il existerait chez certains obèses une déficience d’activité lipolytique ß3 et l’utilisation d’agonistes ß3 dans le traitement de l’obésité est envisagée. Les récepteurs ß3 présynaptiques modulent la libération des catécholamines.
Effets adrénergiques centraux
Les effets des catécholamines au niveau du système nerveux central sont complexes et encore mal précisés.
- La noradrénaline intervient dans la régulation de l’humeur, ce qui explique que des médicaments qui augmentent sa concentration au niveau des synapses en inhibant sa recapture exercent un effet antidépresseur et favorisent le maintien de l’éveil et de la vigilance.
- Il existe au niveau du système nerveux central, en plus des récepteurs postsynaptiques, des récepteurs présynaptiques a2 qui inhibent la libération de noradrénaline, ce qui réduit la stimulation sympathique (diminution de la fréquence des potentiels d’action au niveau de la fibre présynaptique sympathique) et la libération de noradrénaline par les terminaisons adrénergiques périphériques. Leur stimulation par l’a-méthyl-noradrénaline, métabolite de l’a-méthyldopa, entraîne des effets hypotenseurs et sédatifs. Les médicaments agissant comme l’a-méthyldopa sont habituellement appelés sympatholytiques ou hypotenseurs centraux.
- Il existe des récepteurs dits aux imidazolines qui pourraient avoir un agoniste endogène, l’endazoline, et dont la stimulation entraîne des effets similaires à ceux de la stimulation a2. Leur activation par des médicaments comme la clonidine entraîne une inhibition du système sympathique et une diminution de la pression artérielle.
Effets dopaminergiques
La dopamine a des effets périphériques et centraux
Effets périphériques
A doses faibles la dopamine entraîne des effets périphériques spécifiques :
- vasodilatation rénale, mésentérique, coronaire et cérébrale (par effet sur les récepteurs D1) favorisant un abaissement de la pression artérielle
- diminution de la réabsorption tubulaire de Na+ (D2)
- diminution de la libération de rénine et d’aldostérone
- inhibition de la motilité gastroduodénale, probablement par l’intermédiaire d’une inhibition de la sécrétion de la motiline qui est un polypeptide formé de 22 acides aminés
- nausées et vomissements par stimulation de la zone chémoréceptrice qui, bien que centrale, peut être atteinte par voie périphérique, sans nécessiter la traversée de la barrière hémato-encéphalique.
Les effets non spécifiques, qui apparaissent lors de l’administration par voie intraveineuse de dopamine à dose élevée, résultent de la libération de noradrénaline endogène et de la stimulation des récepteurs adrénergiques a et ß (voir précédemment).
Effets centraux
Les effets des médiateurs dont ceux de la dopamine sur le système nerveux central sont complexes et il n’est pas possible d’en donner une description précise. Toutefois un certain nombre de données anatomiques, biologiques et physiopathologiques sont utiles à la compréhension générale du mode d’action des médicaments interagissant avec le système dopaminergique.
- Sur le plan anatomique, on distingue trois principales structures dopaminergiques :
- le faisceau mésocorticolimbique, allant de la partie ventrale du tegmen au Noyau accumbens, jouant un rôle dans les émotions et où prédominent les récepteurs de type D3
- le faisceau nigrostrié allant de la Substantia nigra au striatum, intervenant dans le contrôle des mouvements, où prédominent les récepteurs de type D1 et D2 et qui est altéré en cas de maladie de Parkinson
- le faisceau tubéro-infundibulaire situé au niveau hypothalamo-hypophysaire, intervenant dans la sécrétion de prolactine et où prédominent les récepteurs de type D2
- Sur le plan biologique, les récepteurs dopaminergiques, qui peuvent être présynaptiques et postsynaptiques, sont le plus souvent divisés en cinq types D1, D2, D3, D4 et D5. Le récepteur D5 a des similitudes avec le récepteur D1 et les récepteurs D3 et D4 avec le récepteur D2. L’activation des récepteurs D1 entraîne une stimulation de l’adénylcyclase et l’augmentation de l’AMP cyclique. L’activation des récepteurs D2 inhibe l’adénylcyclase et activerait la phospholipase C. Mais il est encore difficile d’attribuer des fonctions précises à chacun de ces types de récepteurs qui pourraient, en outre, comme les récepteurs D4, présenter des différences polymorphiques en fonction des individus, c’est-à-dire se subdiviser en sous-groupes. L’existence de tel ou tel sous-groupe pourrait être liée à une susceptibilité particulière pour certaines maladies, comme les psychoses, et à l’effet de certains médicaments.
- Sur le plan physiopathologique, on connaît, au moins partiellement, les conséquences d’une déficience ou d’un excès de dopamine.
- La déficience en dopamine par l’altération des neurones dopaminergiques des noyaux gris centraux est responsable des tremblements, de l’akinésie et de la rigidité que l’on observe dans la maladie de Parkinson. Ces symptômes résultent au moins partiellement d’une activité des neurones cholinergiques devenue excessive en raison de la déficience en dopamine.
- Inversement, un hyperfonctionnement du système dopaminergique limbique semble responsable d’au moins un certain nombre de symptômes observés au cours des psychoses et l’administration de neuroleptiques, c’est-à-dire d’antagonistes dopaminergiques de type D2 et D4, les atténue. . Il y aurait chez certains schizophrènes un hypo-activité de type D1 et un hyperactivité de type D2.
- Il existe des récepteurs dopaminergiques présynaptiques qui, lorsqu’ils sont stimulés par la dopamine, inhibent sa propre libération.
- Les produits ou les médicaments qui activent les récepteurs dopaminergiques, directement ou indirectement par augmentation de la concentration de dopamine au niveau de certaines synapses, en inhibant sa recapture ou en favorisant sa libération, entraînent un certain nombre de symptômes caractéristiques :
- Inversement, un hyperfonctionnement du système dopaminergique limbique semble responsable d’au moins un certain nombre de symptômes observés au cours des psychoses et l’administration de neuroleptiques, c’est-à-dire d’antagonistes dopaminergiques de type D2 et D4, les atténue. . Il y aurait chez certains schizophrènes un hypo-activité de type D1 et un hyperactivité de type D2.
- augmentation de la vigilance avec diminution des besoins de sommeil, insomnie
- stimulation locomotrice, logorrhée
- réduction de la sensation de fatigue
- anorexie
- nausées et vomissements
- tendance à la dépendance psychique : l’augmentation de la dopamine au niveau du Noyau accumbens joue un rôle apparemment essentiel dans les mécanismes de la récompense et de la dépendance
- apparition d’un délire, d’hallucinations.
- La déficience en dopamine par l’altération des neurones dopaminergiques des noyaux gris centraux est responsable des tremblements, de l’akinésie et de la rigidité que l’on observe dans la maladie de Parkinson. Ces symptômes résultent au moins partiellement d’une activité des neurones cholinergiques devenue excessive en raison de la déficience en dopamine.
- Sur le plan endocrinien, l’effet majeur de la dopamine est l’inhibition de la sécrétion de prolactine par stimulation des récepteurs D2. La dopamine augmente la sécrétion de l’hormone de croissance, sauf chez les acromégales.