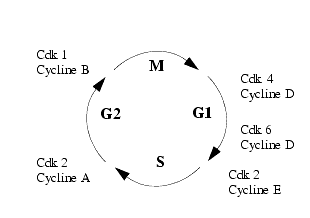
Le cycle cellulaire est divisé en 4 phases : G1, S, G2 et M auxquelles on peut ajouter la phase G0 ou de quiescence. La régulation de la division cellulaire apparaît d’une très grande complexité car il existe des cascades de réactions interdépendantes dont il est difficile de situer le point de départ. Schématiquement la mitose, c’est-à-dire la division elle-même, est précédée des phases G1, S et G2 au cours desquelles la cellule accumule, après mise en jeu de diverses transcriptions, le matériel nécessaire à la naissance de deux cellules-filles. On peut considérer que, pendant les phases G1 et S, il y a activation des gènes conduisant à la synthèse de protéines nécessaires à la synthèse de DNA et pendant la phase G2, synthèse de protéines nécessaires à la séparation et à la migration des chromosomes.
Ces phases sont indiquées ci-après :
- phase G1 (G = gap, intervalle)
- phase S ou de synthèse. La replication du DNA s’effectue grâce à la DNA polymérase de type III.
- phase G2 ou prémitotique
- phase M ou mitotique, de division cellulaire proprement dite
- prophase où le noyau de la cellule contenant les chromosomes est visible
- prométaphase où il y a rupture de l’enveloppe nucléaire et organisation des microtubules (ou kinétophores)
- métaphase où les chromosomes migrent le long des microtubules pour former une plaque équatoriale. Les kinétophores se coupent
- anaphase : migration des chromosomes le long des kinétophores vers les deux pôles de la cellule
- télophase : une enveloppe nucléaire se forme aux deux pôles de la cellule
- cytodiérèse : la cellule mère se divise par clivage en deux cellules filles séparées.
Le cycle cellulaire est régulé par des protéines kinases cycline-dépendante ou Cdk (cyclin-dependant protein kinases) c’est-à-dire que l’activité enzymatique de type kinase nécessite la présence d’une autre protéine appelée cycline.
On distingue plusieurs cyclines et plusieurs Cdk.
Les cyclines, ainsi appelées parce qu’il y a une variation cyclique de leur concentration intracellulaire, D1, D2, D3 liées aux Cdk4 et Cdk6 interviennent à la phase G1 et la cycline E intervient aux phases G1 et S. Les cyclines A dont la concentration s’élève du début de la phase S jusqu’au début de la mitose, liées soit au Cdk2 soit au Cdc2 (partie catalytique d’une protéine kinase dépendant de la cycline A), interviennent aux phases S et G2 et les cyclines B, liées aux Cdk1 et Cdk2, aux phases G2 et M.
Les protéines kinases et les cyclines correspondantes sont régulées par des facteurs de croissance et des oncogènes. Ainsi les Cdk 4 et 6 sont inhibées par des protéines P16, exprimées par le gène CDKN2A qui, lorsqu’il présente une altération secondaire à des mutations, ne les exprime plus : ainsi la freination du cycle cellulaire est levée et le risque de cancers accru.
Les gènes P53 et RB jouent un rôle déterminant dans la régulation du cycle cellulaire.
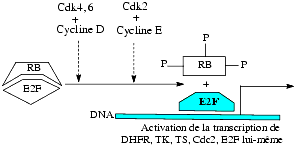
Le gène RB (pour rétinoblastome) code pour une protéine RB qui inhibe la prolifération cellulaire en contrôlant le cycle cellulaire par l’intermédiaire du facteur transcriptionnel E2F. Ce facteur E2F stimule la transcription de gènes conduisant à la synthèse d’enzymes impliquées dans la division cellulaire : la dihydrofolate réductase (DHFR), la thymidine kinase (TK), la thymidylate synthase (TS), la DNA polymérase, les Cdk (cyclin dependant kinases), le Cdc (autre kinase dépendant de la cycline A) et l’E2F lui-même. La protéine RB à l’état non phosphorylé se lie à l’E2F et l’empêche de jouer son rôle d’activateur de transcription des gènes précédemment cités. Par contre, lorsqu’il est phosphorylé, il se détache du facteur E2F qui, dès lors, devient actif. La phosphorylation de la protéine RB est assurée par les Cdk4 et 7 liés aux cyclines D et le Cdk2 lié à la cycline E.
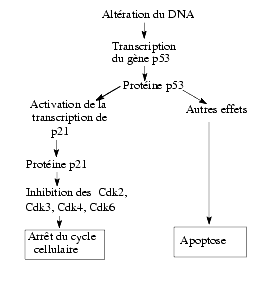
Le gène p53, appelé gène suppresseur de tumeur et localisé dans le bras court du chromosome 1A, code pour une protéine p53. Il est transcrit en cas d’altération du DNA. Cette protéine p53 a de nombreuses fonctions : elle module la transcription de nombreux autres gènes.
- Elle stimule la transcription du gène p21 à l’origine de la protéine p21 qui est un inhibiteur de plusieurs cyclines–Cdk et celle d’autres gènes exprimant des protéines qui inhibent la croissance cellulaire et favorisent l’apoptose.
- Elle réprime la transcription de gènes inhibiteurs de l’apoptose, de c-fos et de c-myc qui sont des oncoprotéines, de MDR1 (multi-drug resistance oncoprotein).
- Elle stimule la transcription du gène mdm2, à l’origine de la phosphoprotéine nucléaire mdm2 qui se lie à la protéine p53 et l’inactive. Il s’agit d’une boucle de régulation négative de la protéine p53.
Par cet ensemble d’actions et d’autres plus complexes qui ne sont pas rappelées ici, le gène p53 freine le cycle cellulaire et favorise l’apoptose. Une altération du gène p53, par mutation par exemple, augmente le risque de cancers.