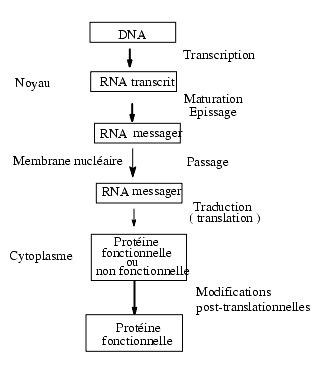
Le schéma simplifié de la synthèse des protéines ne considérant que la transcription du DNA en mRNA et la translation (ou traduction) du mRNA au niveau des ribosomes en protéines ne rend pas compte de la réalité qui est beaucoup plus complexe et ne fait pas intervenir les mécanismes régulateurs.
Toutes les cellules d’un organisme contiennent les mêmes gènes mais dans des cellules données, seuls certains gènes s’expriment c’est-à-dire sont à l’origine de la synthèse de protéines spécifiques.
La transcription du DNA en RNA s’effectue sous l’influence des RNA polymérases dites DNA dépendantes qui sont de type I, à l’origine du rRNA ou RNA ribosomique, de type II, à l’origine du mRNA ou RNA messager, et de type III, à l’origine de la synthèse du tRNA ou RNA de transfert ainsi que du rRNA 5S.
Régulation de la transcription
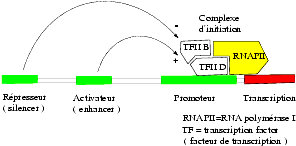
Au niveau du gène, il existe à côté de la partie du DNA qui servira de matrice à sa transcription en RNA – ou région codante – des éléments régulateurs qui sont situés soit en amont (du côté de l’initiation), soit parfois en aval (du côté de la terminaison) de la transcription. L’élément régulateur, partie intégrante du gène, situé à proximité du site d’initiation de la transcription par la région codante, est le promoteur (promoter) appelé aussi élément de réponse (ex : GRE = glucocorticoid-response element). A distance du site d’initiation de la transcription lorsque le DNA est représenté linéairement, on trouve des régulateurs autonomes : ce sont les activateurs (enhancers) qui potentialisent l’action du promoteur ou des represseurs (silencers) qui la répriment.
L’activité des promoteurs et des activateurs est régulée par des protéines appelées TF (transcription factor) comme TFIID (transcription factor D for polymerase II). Ces protéines ont des structures particulières :
- "en doigt de zinc", ainsi appelée parce que l’ion Zn en se liant à 4 acides aminés cystéine et/ou histidine donne à la chaîne polypeptidique un aspect en doigt qui lui permet de venir s’incruster dans les sillons créés par les hélices de DNA.
- en fermeture-éclair par liaison leucine-leucine (leucine zipper), protéines comportant une séquence de 35 acides aminés où l’on trouve une leucine tous les 7 acides aminés. Cette structure permet à la protéine de se dimériser et d’adopter une conformation lui permettant d’interagir avec le DNA. Elle est retrouvée dans les proto-oncogènes Myc, Fos et Jun. Jun peut former un homodimère Jun-Jun. Par contre Fos ne peut pas former un homodimère mais forme un hétérodimère Jun-Fos.
Le complexe d’initiation de la transcription comporte plusieurs protéines dont le facteur de transcription TFIID qui se fixe au promoteur au niveau d’une séquence nucléotidique TATA (riche en thymine et adénine) par son domaine fonctionnel TBP (TATA binding protein) et par ailleurs avec le facteur TFIIB ainsi qu’avec la RNA polymérase qui est alors activée.
Enfin le modelage de la chromatine par interaction entre les protéines basiques, les histones et le DNA modifie l’accessibilité des facteurs transcriptionnels au DNA. Le degré de méthylation du DNA, les modifications des histones par acétylation, ubiquitination, y participent aussi.
Régulation post-transcriptionnelle
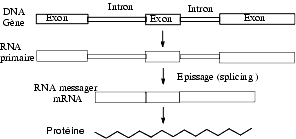
L’une des principales modifications du RNA transcrit est l’épissage (splicing) qui consiste en l’élimination de segments de RNA appelés introns et à la conservation de séquences appelées exons.
Cet épissage s’effectue dans le noyau. Le RNA transcrit à partir du même gène peut, en fonction des cellules, subir des épissages différents et conduire à des mRNA différents et à la synthèse de protéines différentes. Ainsi, à partir du même gène, on peut avoir synthèse de calcitonine dans la thyroïde et synthèse de CGRP (calcitonin gene related protein) dans les neurones. Il s’agit ici d’une régulation qualitative.
Le RNA messager formé migre ensuite dans le cytoplasme à travers des pores de la membrane nucléaire par un processus actif, énergie-dépendant. Dans le cytoplasme le RNA messager sera traduit en protéines. Quand le mRNA est stable, il peut servir plusieurs fois de matrice à la traduction (ou translation) et être à l’origine de la synthèse de plusieurs molécules de la protéine correspondante. Il s’agit ici d’une régulation quantitative. Les mécanismes intervenant dans la stabilisation du RNA sont mal connus.
Régulation translationnelle (traduction)
La traduction ou translation du mRNA dans la protéine correspondante peut aussi être régulée. Il s’agit d’une régulation post-transcriptionnelle s’exerçant au niveau du RNA dont l’exemple le mieux étudié est celui du fer. Le fer interagit avec des protéines appelées IRP (iron regulatory proteins) qui se lient à des structures appelées IRE (iron responsive elements) situées sur les mRNA codant pour la ferritine (un seul site IRE), la 5-aminolévulinate synthase (un seul site IRE) et la transferrine (plusieurs sites IRE). Quand il y a peu de fer dans le cytoplasme, la traduction de ferritine et de 5-aminolévulinate synthase est diminuée alors que celle de la transferrine est augmentée.
Régulation post-traductionnelle
La protéine naissante, directement issue de la traduction du RNA messager, linéaire, succession d’acides aminés dans un ordre bien déterminé, n’est pas fonctionnelle.
Pour être fonctionnelle, la protéine doit prendre une structure tridimensionnelle particulière avec de nombreux repliements. Cette structure active dépend bien sûr de la configuration initiale, c’est-à-dire l’ordre des acides aminés mais aussi de nombreuses réactions enzymatiques conduisant à une conformation cis et trans (peptidyl proline isomerase), à l’établissement de liaisons covalentes (ponts disulfure, glycosylation, acétylation, prénylation) ou à la rupture de liaisons covalentes (hydrolyses). Par ailleurs sa structure dépend de l’intervention de protéines chaperones comme les protéines du choc thermique généralement désignées par HSP (heat shock proteins).
Chez les microorganismes, il existe, à la manière de l’épissage du RNA, un épissage de séquences polypeptidiques appelées intéines qui sont éliminées alors que les extéines situées de part et d’autre se lient, conduisant ainsi à une nouvelle protéine.
De plus, pour être véritablement fonctionnelle, la protéine doit avoir une localisation correcte: intracellulaire – cytoplasme, noyau, mitochondries, membrane plasmique – ou extracellulaire. Le transfert de protéines à partir des ribosomes présents dans le cytoplasme s’appelle translocation et s’effectue par des mécanismes dits d’adressage cellulaire.
On connaît de nombreuses protéines qui sont synthétisées sous forme inactive. Leur activation nécessite une modification post-translationnelle sous l’influence d’une enzyme : protéolyse (voir enképhalines, angiotensine, pré-proinsuline etc.), glycosylation, acétylation, prénylation etc. Cette activité concerne également certaines protéines virales.
De plus beaucoup de protéines sont fonctionnelles sous forme d’hétérodimères résultant de la transcription de gènes différents.
Dégradation des protéines
Les protéines synthétisées sont en renouvellement, c’est-à-dire que parallèlement à leur synthèse, elles sont dégradées. Beaucoup d’entre elles ont un renouvellement rapide ce qui permet à la cellule d’adapter leur concentration. Le système de dégradation intracellulaire comprend la voie vacuolaire avec les lysosomes et la voie ubiquitine–protéasome. Le système de dégradation extracellulaire comporte les métalloprotéinases de la matrice extracellulaire.
Le but de ce rappel sommaire de la synthèse des protéines est de montrer sa complexité qui a deux conséquences un peu contradictoires : une infinité de possibilités de modulation par des médicaments et la difficulté d’avoir des effets spécifiques adaptés au trouble à corriger, sans effets indésirables.