Tout atome ou molécule, neutre ou ionisée, comportant au moins un électron célibataire dans une orbitale externe est un radical libre. Les radicaux libres, souvent appelés simplement radicaux, sont caractérisés par une grande réactivité chimique et une courte durée de vie.
La rupture homolytique d’une liaison covalente donne deux radicaux libres, chaque atome conservant un électron célibataire.
Lorsque deux radicaux libres réagissent, ils peuvent mettre en commun leur électron célibataire pour former un doublet, ce qui entraîne leur disparition en tant que radicaux.
Lorsqu’un radical libre réagit avec une molécule ne comportant pas d’électron célibataire, il provoque la formation d’un nouveau radical.
Par exemple, un radical OH peut transformer une autre molécule comme un acide gras en radical:
![]() OH + LH → H2O +
OH + LH → H2O + ![]() L (L = lipide = acide gras)
L (L = lipide = acide gras)
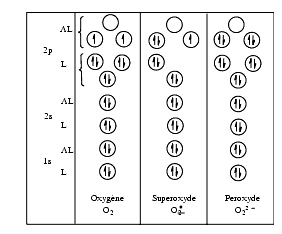
L’oxygène moléculaire O2, est une molécule formée de deux atomes d’oxygène soit 1s2, 2s2, 2p4 ou 8 électrons multiplié par 2. A l’état fondamental l’oxygène est un biradical avec deux électrons célibataires à spins parallèles placés dans des orbitales antiliantes, ![]() O
O ![]() O
O![]() . L’oxygène moléculaire est relativement peu réactif car il réagit seulement avec les molécules ayant comme lui deux électrons célibataires à spins parallèles.
. L’oxygène moléculaire est relativement peu réactif car il réagit seulement avec les molécules ayant comme lui deux électrons célibataires à spins parallèles.
L’anion superoxyde, O2![]() –, est un monoradical avec un électron célibataire. Il est plus instable et plus réactif que la molécule d’oxygène du fait que l’électron supplémentaire se place dans une orbitale antiliante.
–, est un monoradical avec un électron célibataire. Il est plus instable et plus réactif que la molécule d’oxygène du fait que l’électron supplémentaire se place dans une orbitale antiliante.
L’anion peroxyde, O22–, n’est pas un radical mais est très instable du fait de l’existence d’un quatrième électron dans une orbitale antiliante. Dans l’eau, l’anion peroxyde O22– se transforme en peroxyde d’hydrogène ou eau oxygénée, H2O2 ou HOOH, par acceptation de deux protons. L’eau oxygénée joue un rôle très important dans les réactions radicalaires car elle peut donner des radicaux ![]() OH.
OH.
Le radical ![]() OH est un oxydant extrêmement réactif, il interagit instantanément avec les sucres, les acides aminés, les lipides, en particulier les phospholipides, les acides nucléiques.
OH est un oxydant extrêmement réactif, il interagit instantanément avec les sucres, les acides aminés, les lipides, en particulier les phospholipides, les acides nucléiques.
- La coupure homolytique de HOOH, sous l’influence de rayons ionisants par exemple, donne deux radicaux
 OH
OH
- La décomposition de H2O2 catalysée par des métaux, en particulier le fer et le cuivre, donne un radical
 OH.
OH.
- L’interaction de l’eau oxygénée avec l’ion superoxyde donne un radical
 OH :
OH :
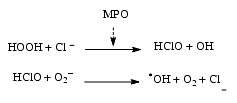
- L’eau oxygénée en présence de chlorure est transformée par la myéloperoxydase (MPO) des neutrophiles en hypochlorite, HOCl, qui, sous l’influence de l’ion superoxyde, est transformé en radical OH, très réactif.
- L’eau oxygénée, HOOH, utilisée comme antiseptique, libère de l’oxygène sous l’influence de la catalase présente dans le sang et les tissus. L’oxygène libéré est à l’origine de son pouvoir antiseptique qui est assez faible et pourrait provoquer des embolies gazeuses si l’eau oxygénée était introduite dans des cavités. En flacons ordinaires, l’eau oxygénée se conserve mal mais il existe actuellement des flacons unidoses et des flacons pulvérisateurs à longue durée de conservation.
- L’hypochlorite de sodium, NaOCl ou eau de Javel (du nom du quai de Javel où il était utilisé pour blanchir le linge), est un désinfectant efficace, notamment contre le virus du SIDA. Les préparations pharmaceutiques à base d’hypochlorite de sodium sont le DAKIN* officinal, fraîchement préparé, le DAKIN COOPER* stabilisé et l’AMUKINE*. L’eau de Javel ne doit pas être mélangée à un acide car, dans ce cas, il y a libération de chlore gazeux extrêmement toxique.
