Les protéines synthétisées par les ribosomes ne deviennent fonctionnelles qu’après un certain nombre de modifications post-traductionnelles (ou post-translationnelles) comme des hydrolyses par des protéases et après adressage, c’est-à dire migration jusqu’à la zone d’activité. Il s’agit d’un processus fondamental qui s’observe du virus à l’homme. Nous n’aborderons ici que les modifications post-traductionnelles qui sont actuellement connues pour être la cible de médicaments.
Inhibiteurs de la protéase du VIH
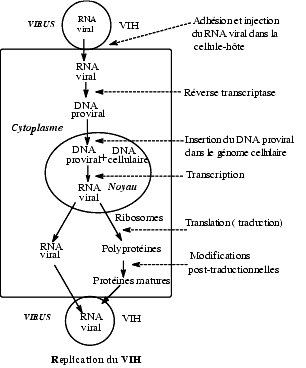
Le schéma ci-après rappelle les principales étapes de la replication du virus de l’immunodéficience humaine, VIH : fixation du virus à la cellule-cible, le lymphocyte T de type CD4+, injection du RNA viral, transcription du RNA viral en DNA proviral grâce à la transcriptase inverse, intégration du DNA proviral dans le génome de la cellule-hôte grâce à l’intégrase, transcription en RNA, traduction en polyprotéines non fonctionnelles, biotransformations post-translationnelles conduisant à des protéines matures et à la formation d’un virus par assemblage du RNA et des protéines. Ce virus forme un bourgeon et se détache de la cellule-hôte. L’étape qui nous intéresse ici est la maturation des protéines sous l’influence d’une protéase qu’il est possible d’inhiber par des médicaments.
Le virus de l’immunodéficience humaine (VIH) transmet son information par trois gènes principaux appelés gag, pol et env qui codent pour des protéines nécessaires à sa replication. Les gènes gag et pol codent pour la polyprotéine gag et la polyprotéine gag-pol. Cette dernière contient une protéase qui, par autocatalyse se détache de la polyprotéine et se dimérise (homodimère), ce qui la rend fonctionnelle. Elle hydrolyse alors les polyprotéines pour libérer les fragments de protéines actifs qui sont notamment : la transcriptase inverse (à l’origine de la transcription du RNA en DNA), l’intégrase qui assure l’insertion du DNA proviral dans le génome de la cellule-hôte, une ribonucléase, les protéines qui vont former la capside, la nucléocapside. Le gène env code pour des protéines de la membrane virale comme Gp120 et Gp41.
Si on inhibe la protéase virale, la replication du virus est bloquée par manque de protéines fonctionnelles nécessaires à la formation d’un virus infectieux. Une recherche systématique a permis de sélectionner des inhibiteurs spécifiques de la protéase virale, c’est-à-dire pratiquement dénués d’effet sur les protéases humaines telles que la rénine, la cathepsine, l’élastase.
Ces inhibiteurs de la protéase virale se sont révélés efficaces dans le traitement du SIDA. Leur administration entraîne une diminution de la charge virale (c’est-à-dire la quantité de RNA viral présent dans le sang des malades) et une augmentation du nombre des lymphocytes CD4+, les plus touchés par l’infection par le VIH. Cependant une résistance à l’effet des inhibiteurs des protéases se développe rapidement lorsqu’ils sont administrés seuls. Pour éviter ou retarder l’apparition de cette résistance, un inhibiteur de la protéase virale n’est jamais utilisé seul mais associé à un ou deux autres médicaments, généralement des inhibiteurs de la transcriptase inverse.
Les médicaments inhibiteurs de la protéase du VIH en cours de développement sont nombreux. Les premiers à être commercialisés ont été le saquinavir, le ritonavir, l’indinavir et le nelfinavir et plus récemment l’amprénavir. Ces inhibiteurs sont des pseudopeptides qui inhibent la protéase du VIH de type 1 et 2, saquinavir, ritonavir, ou préférentiellement de type 1, indinavir, nelfinavir (la fréquence d’infection par le VIH 2 est beaucoup plus faible que par le VIH 1). Parmi les inhibiteurs de la protéase, le saquinavir, en raison sans doute d’une faible biodisponibilité, apparaît moins actif mais une nouvelle présentation, FORTOVASE* a une meilleure biodisponibilité que l’ancienne forme, INVIRASE*. La biodisponibilité de FORTOVASE* est, de plus, augmentée lorsqu’elle est prise au cours des repas. Le lopinavir (ABT-378) est un nouvel inhibiteur de la protéase qui est commercialisé associé au ritonavir. Le tipranavir est une antiprotéase qui est prescrite avec du ritonavir à faible dose. Il a de nombreux effets indésirables, notamment hépaiques. Il augmente le risque d’hémorragies.
| Fosamprenavir | TELZIR* Cp, solution buvable |
| Atazanavir | REYATAZ* Gélules |
| Tipranavir | APTIVUS* Capsule molle |
| Darunavir | PREZISTA* Cp |
Il existe une association lopinavir et ritonavir :
| Lopinavir + Ritonavir | KALETRA* Capsules, Solution |
Sur le plan pharmacocinétique, les inhibiteurs de la protéase du VIH s’administrent par voie orale et sont métabolisés par les cytochromes P450, notamment le CYP 3A4. Leur biodisponibilité peut être ou non modifiée par la prise d’aliments et leur métabolisme modifié par la prise d’autres médicaments. En raison de la diversité des interactions possibles, il est nécessaire de consulter attentivement la monographie de chaque inhibiteur avant de le prescrire. Schématiquement on peut observer :
- une augmentation de la concentration plasmatique de l’inhibiteur des protéases en cas d’administration d’un autre médicament susceptible d’inhiber les cytochromes P450, comme par exemple le kétoconazole. Cette caractéristique s’applique aussi aux antiprotéases entre elles : aussi l’administration concomitante de ritonavir d’une part et de saquinavir, d’indinavir ou de nelfinavir d’autre part augmente la concentration plasmatique de ces dernières en ralentissant leur catabolisme hépatique. Parmi les précédentes antiprotéases, le ritonavir est en effet le plus puissant inhibiteur des cytochromes P450 de types 3A, 2C9 et 2C19.
- une diminution de la concentration plasmatique de l’inhibiteur des protéases en cas de prise concomitante d’un inducteur enzymatique comme la rifampicine.
- une modification de la concentration plasmatique d’un autre médicament par la prise concomitante d’un inhibiteur des protéases.
Ils sont utilisés dans le traitement du SIDA en association à d’autres antiviraux.
Divers effets indésirables peu spécifiques, troubles digestifs, neurosensoriels, cutanés parfois graves, généraux, ont été répertoriés. Un autre effet indésirable est l’apparition d’une résistance croisée aux inhibiteurs des protéases. On peut en outre signaler que l’indinavir peut donner une lithiase des voies biliaires par cristallisation se traduisant par des douleurs lombaires avec ou sans hématurie, lithiase que l’on tend à prévenir par un apport hydrique suffisant. Pour le moment le traitement du SIDA est lourd avec prises quotidiennes répétées de plusieurs médicaments et indéfiniment prolongé.
D’autres inhibiteurs de protéases virales sont en cours de développement comme par exemple les inhibiteurs de la protéase du virus de l’hépatite C.
Le raltégravir est un inhibiteur de l’intégrase du V1H commercialisé sous le nom d’ISENTRESS*.
Inhibiteurs d’autres modifications post-traductionnelles
En dehors des protéases virales que nous venons de voir, il existe aussi des protéases humaines à l’origine de biotransformations post-translationnelles. Ces protéases scindent la pro-opiomélanocortine, le précurseur de l’insuline, l’angiotensinogène (rénine et enzyme de conversion). Ainsi, les inhibiteurs de l’enzyme de conversion sont des inhibiteurs de protéases à activité post-translationnelle.
En plus des hydrolyses, il existe différentes biotransformations post-translationnelles : glycosylation (addition d’un sucre tel que le glucose), acylation (addition d’un acide) par exemple myristoylation (addition d’un résidu acide myristique, méthylation et prénylation (appelée aussi isoprénylation parce qu’il y a addition d’une chaîne comprenant une ou plusieurs unités de 5 atomes de carbone de type isoprène). La prénylation comprend la farnésylation (addition d’une chaîne de 15 atomes de carbone) et la géranyl-géranylation (addition d’une chaîne de 20 atomes de carbone).
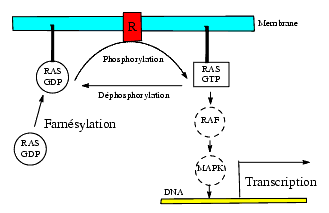
La biotransformation post-translationnelle qui pourrait dans un proche avenir servir de cible à des médicaments est la farnésylation à partir du farnésyl pyrophosphate sous l’influence d’une farnésyltransférase du fait que la farnésylation de la protéine Ras est un préalable à son activation. Le gène Ras code pour une protéine de 21 Kda, appelée p21 ou Ras qui, sous forme de RAS-GDP se trouve dans le cytoplasme sous forme inactive. La farnésylation de RAS-GDP permet sa fixation à la partie interne de la membrane plasmique par la chaîne farnésyl. Sous l’influence d’une stimulation de récepteurs membranaires, il est transformé en RAS-GTP qui à son tour active Raf et MAP, conduisant à une activation de la transcription génique et à une prolifération cellulaire. RAS joue en quelque sorte le rôle d’un interrupteur capable de déclencher une prolifération cellulaire.
L’activité de RAS-GTP est stoppée par sa déphosphorylation sous l’influence de RAS-GTPases. Dans divers cancers, on trouve des RAS-GTP résistants à l’hydrolyse par les RAS-GTPases, ce qui se traduit par une stimulation permanente de la transcription.
L’élévation de RAS s’observe dans un très grand nombre de cancers et l’inhibition de la farnésylation se traduit par un effet antitumoral. De nombreux inhibiteurs de la farnésyltransférase sont en cours d’évaluation. Il s’agit d’inhibiteurs entrant en compétition soit avec le farnésylpyrophosphate, soit avec la partie protéique où se fixe le farnésyl, structure de type CAAX où C = cystéine, A = acide aminé aliphatique et X = un autre acide aminé, soit avec les deux à la fois. Le point essentiel est que les inhibiteurs de la farnésyltransférase agissent préférentiellement sur les cellules cancéreuses par rapport aux cellules normales, par l’intermédiaire de RAS et d’autres protéines appelées Rho.