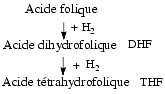Le terme d’acide folique ou de folates désigne parfois l’acide folique lui-même, mais le plus souvent un groupe de composés synthétisés par les plantes et les micro-organismes, mais non par l’homme auquel ils sont indispensables car ils interviennent dans le transfert des groupes monocarbonés nécessaires, notamment, à la synthèse des bases puriques et d’une base pyrimidique, la déoxythymidine.
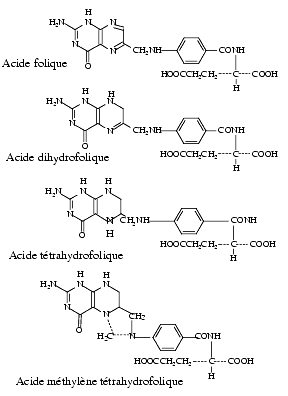
L’acide folique comporte un noyau ptérine et un acide para-amino-benzoïque lié à une ou plusieurs molécules d’acide glutamique. La ptérine et l’acide para-amino-benzoïque sont désignés habituellement sous le terme d’acide ptéroïque. L’acide para-amino-benzoïque est un facteur de croissance pour les bactéries dont l’effet est antagonisé par les sulfonamides.
Les formes réduites, indispensables à l’activité biologique, sont l’acide dihydrofolique ou dihydrofolate (DHF) et l’acide tétrahydrofolique ou tétrahydrofolate (THF) provenant d’une réduction par fixation d’atomes d’hydrogène.
La forme réduite, THF, peut fixer réversiblement sur ses atomes d’azote N5 et/ou N10 des radicaux mono-carbonés méthyl-CH3, méthylène-CH2, méthényl-CH, formyl-CHO, formimino-CH=NH et hydroxy-méthyl-CH2-OH. Elle fournit les groupes monocarbonés nécessaires aux réactions enzymatiques.
L’acide 5-formyl-tétrahydrofolique, appelé aussi leucovorine, citrovorum factor ou habituellement acide folinique, est actif sans l’intervention de la dihydrofolate réductase ni celle de la sérine hydroxyméthyl transférase, car il comporte déjà un groupe monocarboné. La forme active serait, en fait, le N5-N10-méthylène-tétrahydrofolate.
- La tétrahydrobioptérine (BH4), ou saproptérine, se différencie de la ptéridine par l’existence d’une fonction amine-NH2 et d’une chaîne propyl avec deux alcools en position contiguë. Elle est synthétisée par l’organisme à partir de la guanosine triphosphate et n’appartient pas au groupe des vitamines car le rôle de l’apport exogène semble négligeable. Elle intervient dans les réactions d’hydroxylation, notamment celle de la phénylalanine en tyrosine, de la tyrosine en dihydroxyphénylalanine et du tryptophane en 5-hydroxytryptophane, étapes limitantes de la biosynthèse des catécholamines et de la sérotonine. La déficience en tétrahydrobioptérine peut se traduire par des troubles neuropsychiatriques. Elle a donné des résultats intéressants dans le traitement de la phénylcétonurie en faisant baisser la concentration de phénylalanine. Elle est commercialisée dans certains pays sous le nom de KUVAN*.
- La molybdoptérine nécessaire à l’activité de la xanthine oxydase et de la sulfite oxydase a une structure proche de celle de la bioptérine, mais comporte en plus un atome de molybdène. En cas de déficience en molybdoptérine, il y a augmentation dans l’urine de l’hypoxanthine, de la xanthine et du sulfite et diminution de l’acide urique et du sulfate.