Les protéines sont renouvelées en permanence, c’est-à-dire qu’il existe parallèlement à la synthèse des processus de dégradation. La vitesse de renouvellement ou turnover est très différente selon les protéines, avec des T1/2 allant de quelques minutes à un jour pour les protéines intracellulaires et beaucoup plus pour des protéines extracellulaires comme l’hémoglobine.
On pensait que les lysosomes, organelles intracellulaires contenant des enzymes protéolytiques, connus pour intervenir dans l’endocytose dont la phagocytose, jouaient un rôle important dans la dégradation des protéines endogènes intracellulaires En réalité la dégradation de ces protéines est assurée pour l’essentiel par le protéasome.
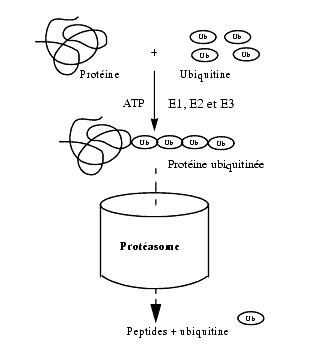
Le protéasome, mot résultant de l’association de "protéase" et de "some "qui signifie particule ou organite, est un complexe protéique cylindrique creux, mesurant 10 nm de diamètre et 15 nm de long, de localisation cytosolique et intranucléaire. Le protéasome 26S est constitué d’un complexe 20S formant le cylindre central et de 2 complexes régulateurs 19S situés à chaque bout du cylindre. L’activité protéolytique du protéasome 20S est régulée par la protéine 19S et par une protéine 11S. L’activité protéolytique de ce complexe est située à l’intérieur du cylindre dans lequel entre le substrat ubiquitiné qui sera hydrolysé.
Pour être dégradée par le protéasome 26S, les protéines intracellulaires doivent en général être au préalable ubiquitinées. L’ubiquitine est elle-même une protéine de 76 acides aminés, présente dans toutes les cellules d’où son nom. Sous l’effet d’enzymes appelées E1 (activatrice), E2 (conjugase) et E3 (ligase) et en présence d’ATP, il y a biosynthèse d’une chaîne poly-ubiquitine qui est liée par le groupe -COOH d’un résidu glycine terminal au groupe -NH2 d’un résidu lysine de la protéine à dégrader. La protéine ainsi poly-ubiquitinée est un substrat du protéasome 26S qui l’hydrolyse en peptides de 3 à 25 acides aminés qui seront partiellement hydrolysés en acides aminés, lesquels pourront être réutilisés par la cellule. Les molécules d’ubiquitine libérées par dé-ubiquitination seront également réutilisées.
Le système ubiquitine-protéasome 26S dégrade un grand nombre de protéines usagées ou en excès, récepteurs, transporteurs, enzymes, facteurs transcriptionnels, cyclines, protéines virales. Il intervient également dans la dégradation d’un antigène d’origine endogène en un fragment peptidique qui sera présenté à la surface de la cellule.
Sur le plan physiopathologique on n’a guère de données établissant un lien clair entre une maladie et un trouble qualitatif ou quantitatif, par excès ou par défaut, de l’activité du système ubiquitine-protéasome.
Sur le plan pharmacologique, la modification de l’ubiquitination et de la protéolyse, par inhibition ou par stimulation, peut avoir des conséquences intéressantes. Par exemple l’inhibition de ce système de dégradation conduit à la mort des cellules néoplasiques mais aussi des cellules normales. La difficulté est de trouver des substances à effets spécifiques.
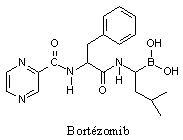
Parmi les substances inhibitrices testées expérimentalement on peut citer des substances naturelles commela lactacystine et l’époxomycine et des substances de synthèse comme le bortézomib.
|
Bortézomib |
VELCADE* Inj IV |
Le bortezomib est un inhibiteur du protéasome 26S. Son indication est le traitement du myélome multiple déjà traité et s’aggravant en dépit des autres traitements en cours. Il a de nombreux effets indésirables.
- La maladie de Gaucher, autosomale récessive, résulte d’un trouble du catabolisme des lipides et non des protéines. Dans cette maladie il existe au niveau lysosomal une déficience en glucocérébrosidase, enzyme qui normalement présente, dégrade les glucocérébrosides (sphingolipides). Lorsque cette enzyme est absente ou défectueuse les glucocérébrosides s’accumulent en particulier dans les monocytes et les macrophages qui deviennent hyperplasiques et entraînent secondairement une splénomégalie, une hépatomégalie et une atteinte de la moelle osseuse.
- Le traitement actuel de la maladie de Gaucher consiste à administrer une glucocérébrosidase obtenue par génie génétique et modifiée pour lui permettre de pénétrer dans les cellules
- Le miglustat est un sucre aminé qui inhibe la glucosyltransférase ou glucosyl-céramide synthase, enzyme impliquée dans la biosynthèse des glycolipides ou glucosyl-céramides. L’inhibition de la glucosyl-céramide synthase réduit l’accumulation des glycolipides. Le miglustat est commercialisé dans certains pays sous le nom de Zavesca*. Il est utilisé dans le traitement de la maladie de Gaucher de type 1 lorsqu’il n’est pas possible de recourir à l’imiglucérase ou Cérézyme* qui reste le traitement de référence.
Ultérieurement on peut espérer que la thérapie génique s’appliquera à cette maladie. - Le traitement actuel de la maladie de Gaucher consiste à administrer une glucocérébrosidase obtenue par génie génétique et modifiée pour lui permettre de pénétrer dans les cellules
- Précédent
- Suivant
